Окраска туберкулезной палочки
Содержание
- 1 Содержание
- 2 Морфология возбудителя туберкулёза [ править | править код ]
- 3 Генетика и эволюция Mycobacterium tuberculosis [ править | править код ]
- 4 Молекулярный патогенез: взаимодействие микобактерий с клеткой [ править | править код ]
- 5 Микобактериальная фагосома [ править | править код ]
- 6 Жизнестойкость [ править | править код ]
- 7 Культивация [ править | править код ]
| Mycobacterium tuberculosis | |
|---|---|
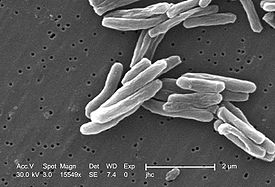 M. tuberculosis 15549x, СЭМ |
|
| Научная классификация | |
| Домен: | Бактерии |
| Класс: | Актинобактерии |
| Порядок: | Актиномицеты |
| Подпорядок : | Corynebacterineae |
| Семейство: | Mycobacteriaceae |
| Вид: | Mycobacterium tuberculosis |
Mycobacterium tuberculosis (Zopf 1883) Lehmann and Neumann 1896
Mycobactérium tuberculósis (лат.) , па́лочка Ко́ха (МБТ, BK) — вид микобактерий, типовой вид семейства Mycobacteriaceae, выделен 24 марта 1882 года Робертом Кохом (24 марта объявлено ВОЗ Всемирным днём борьбы с туберкулёзом).
Входит в группу близкородственных видов MTBC (англ. Mycobacterium tuberculosis complex ), (M. tuberculosis, M. bovis, M. africanum, M. microti, M. pinnipedii и M. caprae), способных вызывать туберкулёз у человека и некоторых животных. Является наиболее изученным видом из этой группы.
Бактерии, входящие в MTBC, имеют высокую степень родства (порядка 99,9 %) и идентичны по последовательностям 16S рРНК.
Содержание
Морфология возбудителя туберкулёза [ править | править код ]
МБТ относятся к прокариотам (в их цитоплазме нет высокоорганизованных органелл — аппарата Гольджи, лизосом). Отсутствуют также характерные для части прокариотов и некоторых других видов микобактерий плазмиды, обеспечивающие для микроорганизмов динамику генома. В сущности, элементы динамики генома обеспечивается способностью МБТ к мутации, а точнее к перемещению транспозонной последовательности IS6110, что обеспечивает наличие в популяции особей с генами, «выключенными» из работы, что обеспечивает, например, устойчивость особей к тем или иным антибиотикам.
Форма — слегка изогнутая или прямая палочка 1—10 мкм диаметром 0,2—0,6 мкм. Клетки с характерным свойством кислото- и спиртоустойчивой (на одной из стадий роста) окраски, являются аэрофилами и мезофилами (диапазон температур 37—42 °C), однако в процессе жизнедеятельности в неблагоприятных условиях метаболизм может измениться, а клетки трансформироваться в микроаэрофилы и даже становиться анаэробами. По потреблению кислорода и развитости оксидазных систем микобактерии схожи с истинными грибами. В качестве связующего звена между НАДН-дегидрогеназой и цитохромом b в переносящей системе рода Mycobacterium служит Витамин K9. Эта система цитохромов напоминает митохондриальную эукариотов. Она чувствительна к динитрофенолу, так же как и у высших организмов. Описанный тип дыхания — не единственный источник образования АТФ. Кроме O2-терминальной, микобактерии могут использовать дыхательные цепи, переносящие электроны и оканчивающиеся нитратами (NO3 − ). Резервом дыхательной системы микобактерий является ещё и глиоксилатный цикл. Бескислородное (эндогенное) дыхание, проявляющееся в атмосфере с концентрацией кислорода менее 1 %, стимулирует азидные соединения, которые уменьшают окисление пирувата или трегалозы.
Тинкториально — слабо грамположительные. Для дифференцировки окрашивают по Цилю — Нельсену или используют окраску флюорохромами.


Микобактерии неподвижны, не образуют спор и капсул. Конидии также отсутствуют. Растут на плотных питательных средах медленно: при оптимальной температуре видимые колонии появляются через 34—55 сут (присутствие в среде L-аспарагина или глутамината натрия ускоряет рост на плотных средах в 1,5 раза). Колонии чаще характерного цвета «слоновой кости», но бывают слабо пигментированные розовые или оранжевые, особенно при росте на свету.

Пигмент не диффундирует. Поверхность колоний обычно шероховатая (R-тип). В микроколониях М. tuberculosis (то есть на ранних сроках) и в жидких питательных средах образуются структуры, напоминающие «косы» или «жгуты» — признак, который связывают с корд-фактором.

Нередко микобактерии растут в виде слизистых или морщинистых колоний. На жидких средах микобактерии могут расти на поверхности. Нежная сухая плёнка со временем утолщается, становится бугристо-морщинистой и обретает желтоватый оттенок. Бульон остаётся прозрачным, и добиться диффузного роста удаётся в присутствии детергентов (ПАВ). При окраске карболовым фуксином и метиленовым синим микобактерии туберкулёза выявляются в виде тонких, слегка изогнутых палочек малиново-красного цвета, содержащих различное количество гранул. Иногда можно обнаружить изогнутые или извитые варианты. Микроорганизмы, располагающиеся поодиночке, парами или в виде групп, хорошо выделяются на голубом фоне других компонентов препарата. Нередко бактериальные клетки могут располагаться в виде римской цифры «V». В препарате можно выявить также изменённые кокковидные кислотоустойчивые формы возбудителя, округлые сферические или мицелиеподобные структуры. В этом случае положительный ответ должен быть подтверждён дополнительными (культуральными) методами исследования [2] .
В бактериальной клетке дифференцируется:
- клеточная стенка — состоящая из 3—4 связанных слоёв толщиной до 200—250 нм, содержит специфичные воска (микозиды) полисахариды, защищает микобактерию от воздействия внешней среды, обладает антигенными свойствами и проявляет серологическую активность; ограничивает микобактерию снаружи, обеспечивает стабильность размеров и формы клетки, механическую, осмотическую и химическую защиту, включает факторы вирулентности — липополисахариды, с фосфатидной фракцией которых связывают вирулентность микобактерий;
- бактериальная цитоплазма; может содержать гранулы;
- цитоплазматическая мембрана — включает липопротеиновые комплексы, ферментные системы, формирует внутрицитоплазматическую мембранную систему (мезосому);
- ядерная субстанция — состоит из одной кольцевой ДНК.
Белки (туберкулопротеиды) являются главными носителями антигенных свойств МБТ и проявляют специфичность в реакциях повышенной чувствительности замедленного типа. К этим белкам относится туберкулин. С полисахаридами связано обнаружение антител в сыворотке крови больных туберкулёзом. Липидные фракции способствуют устойчивости микобактерий к кислотам и щелочам.
Метаболизм и развитие МБТ в разных условиях [ править | править код ]
МБТ не выделяют эндо- и экзотоксинов, поэтому при инфицировании ими ярких клинических симптомов, как правило, не возникает. По мере размножения МБТ и формирования повышенной чувствительности тканей к туберкулопротеидам возникают первые признаки инфицирования (положительная реакция на туберкулин).
МБТ размножаются простым делением на две клетки. Цикл деления — 14—18 часов. Иногда размножение происходит почкованием, редко ветвлением.
МБТ весьма устойчивы к воздействию факторов внешней среды. Вне организма сохраняют жизнеспособность много дней, в воде — до 5 месяцев. Но прямой солнечный свет убивает МБТ в течение полутора часов, а ультрафиолетовые лучи — за 2—3 минуты. Кипящая вода вызывает гибель МБТ во влажной мокроте через 5 минут, в высушенной — через 25 минут. Дезинфектанты, содержащие хлор, убивают МБТ в течение 5 часов.
МБТ, поглощённые макрофагами в процессе фагоцитоза, сохраняют свою жизнеспособность длительное время и могут вызывать заболевание после нескольких лет бессимптомного существования.
МБТ могут образовывать L-формы, имеющие сниженный уровень метаболизма и ослабленную вирулентность. L-формы могут длительное время персистировать (сохраняться) в организме и индуцировать (вызывать) противотуберкулёзный иммунитет.
МБТ могут существовать в виде очень мелких фильтрующихся форм, которые выделяются у больных, длительно принимавших противотуберкулёзные препараты.
Генетика и эволюция Mycobacterium tuberculosis [ править | править код ]
Разнообразие свойств данного микроорганизма определяется её хромосомой. Геном M. tuberculosis complex очень консервативен. Его представители обладают гомологией ДНК в пределах 85—100 %, тогда как ДНК других представителей данного рода гомологичны M. tuberculosis лишь на 5—29 % [3] . Геном M. tuberculosis меньше, чем у других микобактерий. У классического возбудителя туберкулёза человека, M. tuberculosis, больше генов, чем у M. africanum и M. bovis, которые утратили часть генетического материала в ходе эволюции.
В 1998 г. была опубликована нуклеотидная последовательность хромосомы штамма H37Rv M. tuberculosis, являющегося музейным «классическим» штаммом. Хромосома представляет собой тороидальную структуру — свыше 4000 генов, кодирующих белки, плюс 60, кодирующих функциональные компоненты РНК: уникальный рибосомальный РНК-оперон, 10Sа РНК, участвующий в деградации белков с нетипичной матричной РНК, 45 транспортных РНК (тРНК), около 100 липопротеинов.
Особенность генома M. tuberculosis complex — большое число повторяющихся последовательностей ДНК. Так, в хромосоме M. tuberculosis Н37Rv насчитывают до 56 копий IS-элементов, которые обеспечивают ДНК-полиморфизм микобактерий туберкулёза (эту особенность используют в ПЦР-диагностике). Большинство из них, за исключением элемента IS6110, неизменны. В составе хромосомы различных штаммов микобактерий туберкулёза, как правило, присутствует от 5 до 20 копий IS6110, однако встречаются штаммы, не имеющие данного элемента. Различия в количестве копий и локализации на хромосоме этих генетических элементов используют для дифференциации штаммов микобактерий туберкулёза в молекулярной эпидемиологии. Наиболее совершённые схемы генотипирования микобактерий основаны на выявлении геномного полиморфизма, обусловленного элементом IS6110. Характерно, что дивергенция вида M. tuberculosis происходит, как правило, за счёт рекомбинаций между копиями элемента IS6110, которые фланкируют различные гены.
Фактически с самого начала применения антибиотикотерапии возник феномен лекарственной устойчивости. Феномен потому, что микобактерия не имеет плазмид, а популяционная устойчивость микроорганизмов к антибактериальным препаратам традиционно описывалась в микробной клетке наличием R-плазмид (от англ. resistance — устойчивость). Однако, несмотря на этот факт, отмечалось появление или исчезновение лекарственной устойчивости у одного штамма МБТ. В итоге выяснилось, что за активацию или дезактивацию генов, отвечающих за резистентность, ответственны IS-последовательности.
В употребление вошёл термин «мутации МБТ». Он означает выявленную генетическими методами (ДНК-зонды и ПЦР-РВ) устойчивость к антибактериальным препаратам, однако следует понимать, что здесь мы имеем дело с «псевдомутациями», обусловленными временным внедрением IS-последовательности в определённый участок гена.
Особое место занимает генетическое семейство Beijing (Пекин), впервые выявленное в гистологических препаратах лёгочной ткани в 1956—1990 гг. от больных предместья китайской столицы. В этой группе частота множественной лекарственной устойчивости значительно выше, чем среди представителей других семейств. На сегодняшний день штаммы этого семейства обнаружены в государствах Азии, Южной Африки, странах Карибского бассейна, США. Распространение данного генотипа на различных территориях определяется этническими характеристиками коренного населения и мигрантов. Недавно получены данные о распространении штаммов генотипа S1/Beijing на северо-западе европейской части России (Санкт-Петербург), некоторых регионах Сибири, а также на территории Дальневосточного федерального округа.
Молекулярный патогенез: взаимодействие микобактерий с клеткой [ править | править код ]
Микобактерии туберкулёза относят к внутриклеточной инфекции, с чем связывают их высокую способность к персистенции. Первично инфицируют макрофаги хозяина, развивая особые стратегии выживания и размножения в этих высокоспециализированных клетках. Используя способность макрофагов образовывать специализированные органеллы — фагосомы, микобактерии приспособили эти органеллы для своей жизнедеятельности, при этом получая несомненные преимущества, необходимые для избегания действия защитных «хозяйских» механизмов, таких как антитела и система комплемента.
При помощи маннозного рецептора, а также рецепторов системы комплемента (CR1, CR3 и CR4) микобактерии связываются с мембраной макрофага и фагоцитируются внутрь клетки. Внутри фагосомы микобактерии производят её ремоделинг таким образом, что нарушают процесс её созревания и дальнейшее слияние с лизосомой для образования фаголизосомы.
Микобактериальная фагосома [ править | править код ]
В отличие от нормальной фагосомы, микобактериальная имеет значительные различия в составе мембран и их внутреннего содержимого. Микобактерии задерживают созревание фагосомы на ранней стадии, не позволяя ей в дальнейшем слиться с лизосомой для образования фаголизосомы, в которой происходит лизис клеток микроорганизмов. Поэтому эта фагосома имеет маркеры раннего этапа созревания (англ. early endosome ), такие как rab5, coronin-1, кроме того, существует активное взаимодействие между ранними эндосомами и микобактериальной фагосомой, что обеспечивает микобактерии питательными веществами.
Жизнестойкость [ править | править код ]
МБТ очень устойчива в окружающей среде. Так, при температуре 23 °C во влажном и тёмном месте она сохраняется до 7 лет. В тёмном и сухом месте (при высыхании мокроты больного или в пыли) МБТ сохраняется до 10—12 месяцев, в уличной пыли (то есть в сухом и светлом месте) палочка Коха сохраняется до 2 месяцев, на страницах книг — до 3 месяцев, в воде — до 5 месяцев. В почве МБТ сохраняется до 6 месяцев, в сыром молоке — до 2 недель, в масле и сыре — до года.
На сегодняшний день считают, что микобактерии туберкулёза, находящиеся в мокроте, остаются жизнеспособными при открытом кипячении последней в пределах 5 мин. Микобактерии чувствительны к средствам, содержащим хлор (хлорная известь, хлорамин и др.) и третичные амины, а также к перекиси водорода.
Культивация [ править | править код ]
В качестве стандартной среды для культивирования микобактерий туберкулёза ВОЗ рекомендована плотная яичная среда Левенштейна — Йенсена. В России и некоторых других странах широкое распространение получила рекомендованная в качестве второй стандартной яичная среда Финна-II с несколько более высоким процентом выделения микобактерий [4] [5] . Для повышения вероятности роста микобактерий в настоящее время рекомендуется засеивание патологического материала на 2—3 среды одновременно.
В результате такой окраски часть бактерий, несмотря на воздействие спиртом, сохраняет фиолетовый цвет — это так называемые грам-положительные бактерии, другая же часть бактерий теряет в этих условиях фиолетовую окраску и дополнительно окрашивается в розовый цвет — это грам-отрицательные бактерии. Поэтому-то важным моментом и является обесцвечивание мазка: если передержать его в спирту, все бактерии потеряют первоначальный цвет, если же воздействие спиртом окажется недостаточным, все они будут выглядеть как грам-положительные.
Из бактерий, встречающихся в мокроте и обнаруживаемых при окраске по Граму, практическое значение имеют следующие виды их:
а). Пневмококк, или ланцетовидный капсульный диплококк Френкель-Вексельбаума, встречается главным образом при крупозной пневмонии, но может быть обнаружен и при лобулярной пневмонии и иногда, как дополнительная инфекция, при туберкулезе. Это парный кокк, не имеющий правильной круглой формы, а заостряющийся кнаружи и закругленный кнутри («пламя свечи»), грам-положителен. В свежей мокроте удается видеть капсулу в виде светлого ободка. Значительный практический интерес, в связи с серотерапией пневмоний, представляет изучение типа, к которому относится пневмококк. В настоящее время установлено существование четырех типов пневмококка, морфологически неотличимых. Диагноз ставится путем заражения животных и последующей реакции агглютинации. Пневмококки, относящиеся к I, II, и III типам, агглютинируются только сыворотками соответствующей группы. Тип IV неоднороден и обозначается как тип X.
Определение типа пневмококка, помимо реакции атглютинации, ориентировочно производится также более простым, но и менее точным способом Нейфельда (Neufeld), основанным на появлении феномена набухания капсулы. Техника способа в основном такова. На предметное стекло наносятся три частицы мокроты, затем к каждой из них прибавляется по петле одной из агглютинирующих сывороток (типа I, II и III) и по одной петле синьки Леффлера. Стекло кладется на 10-15 минут во влажную камеру. Затем каждая частица мокроты накрывается покровным стеклом и рассматривается под микроскопом. Набухание капсулы будет происходить только в том препарате, к которому прибавлена сыворотка, агглютинирующая данный тип пневмококка.
б. Пневмобациллы (или диплобациллы Фридлендера) могут также являться возбудителями крупозной пневмонии, ухудшая течение заболевания и прогноз, но иногда
встречаются и при лобулярной пневмонии. Это довольно толстые парные палочки с за-
кругленными концами, заключенные в капсулу, грам-отрицательны.
в. Веретенообразная палочка (Вас. fusiforalis) и спирохета, встречаясь одновременно, считаются возбудителями гангрены легкого. Вас. fusiformis — довольно длинная грам-отрицательная палочка, заостряющаяся по направлению к концам, нередко
с просветом в центральной части. Спирохеты также грам-отрицательны, очень нежны,
форма завитков неправильная, количество их 2-3.
г. Стафилококки и стрептококки нередко находятся в мокроте больных с абсцессом легких, возбудителем которого они в ряде случаев и являются. Они грам-положительны. Нужно иметь в виду, что единичные стрептококки могут встретиться в любой
мокроте.
д. Бациллы инфлуэнцы, катаральный микрококк, micrococcus tetragenes, Вас.
pyocyaneus встречаются реже, нахождение их в мокроте имеет меньшее значение.
з. Окраска туберкулезной палочки. В основу всех методов положено особое свойство туберкулезной палочки, которым обладают, впрочем, также лепрозная палочка и некоторые сапрофиты. Эти бактерии с трудом воспринимают окраску, поэтому требуют применения подогревания и прибавления к анилиновой краске протравляющих веществ. С другой стороны, с трудом однажды окрасившись, они прочно удерживают краску, не обесцвечиваясь от воздействия кислотами и спиртом, т. е. являются кислото- и спиртоустойчивыми. Из многочисленных методов, предложенных для окраски туберкулезных палочек, наиболее распространенным является классический метод Циль-Нильсена (Ziehl-Neelsen). На высушенный и зафиксированный мазок мокроты накладывается аккуратно вырезанная полоска фильтровальной бумаги и наливается карболовый фуксин Циля. Стекло захватывается пинцетом Корнета и подогревается над пламенем спиртовки (держать на высоте около 20 см) до образования паров. Нужно следить, чтобы на препарате при подогревании все время была краска, чтобы бумажка была «сочной»; по мере испарения краску следует подливать, иначе может выпасть осадок, который испортит препарат. После появления паров подогревание прекращается, а бумажка с краской оставляется на 2-3 минуты. Затем бумажка сбрасывается, препарат промывается водой и опускается в стаканчик с 10-15% серной кислотой (можно пользоваться и 10% азотной или 3% соляной кислотой). Вместо того чтобы опускать препарат в кислоту, можно залить его сверху. Приблизительно через минуту препарат вынимается из кислоты и промывается водой. Если при этом он оказывается интенсивно розовым, обесцвечивание недостаточно, и его надо повторить до сохранения препаратом слабо-розового оттенка. Наконец, для дополнительного окрашивания всех элементов, которые обесцветились, на мазок наливается водный раствор метиленовой синьки (1 : 1000) на полминуты. Мазок снова промывается водой и прослушивается. Итак, способ состоит из следующих моментов: 1) окраска в основной цвет всех элементов мазка, 2) обесцвечивание всех их, кроме туберкулезной палочки, и 3) дополнительная окраска. При окраске по Циль-Нильсену, следовательно, туберкулезная палочка окрашивается в красный цвет и находится на голубом фоне.
Вид туберкулезной палочки под микроскопом довольно разнообразен, чаще, однако, это тонкие изящные довольно длинные палочки, прямые или изогнутые, расположенные поодиночке или кучками, иногда под углом друг к другу. Нередко встречаются четкообразные, фрагментированные формы. Количество туберкулезных палочек в мокроте очень разнообразно — от единичных во всем препарате до колоссального насыщения ими, при котором мазок производит впечатление чистой культуры. Подсчет палочек по полям зрения большого значения не имеет, тем более что они распределяются очень неравномерно. Нельзя удовлетворяться отрицательным результатом однократного исследования; в случае малейшего подозрения на туберкулез его надо повторить несколько раз.
Иногда приходится прибегать к методу насыщения препарата после предварительной гомогенизаций мокроты. Существует, правда, взгляд, что тщательное повторное исследование обычного мазка мало в чем уступает таким кропотливым методам. Одним из распространенных способов этого рода является способ обработки антиформином Уленгута (Uhlenhuth). 1 часть мокроты смешивается с 1-2 частями 25% раствора антиформина и сильно взбалтывается, после чего оставляется до полного растворения (гомогенизация). Затем к жидкости прибавляется около одной трети объема дистиллированной воды, и она центрифугируется полчаса. Жидкий слой сливается быстрым опрокидыванием пробирки, причем она остается в таком положении минут 5-10 на подстилке из фильтровальной бумаги — до полного извлечения воды. Из осадка приготовляется мазок, который высушивается, фиксируется и окрашивается по Циль-Нильсену.
Кислотоупорные палочки в мокроте можно считать, несомненно, туберкулезными, но следует все-таки иметь в виду, что очень редко, правда, кислотоупорные палочки могут встретиться в мокроте при отеке, гангрене легкого, бронхэктазиях.
Посев . Во всех подозрительных на туберкулез случаях, где повторное тщательное бактериологическое исследование остается безрезультатным, следует произвести посев мокроты на одну из специальных сред. Рост палочек может продолжаться в течение срока от 7 дней до 3 месяцев.
Кроме туберкулеза, посев мокроты производится и при острых инфекциях с целью выявления возбудителя или более точного выяснения его характера, например при крупозной пневмонии для определения типа пневмококка, что имеет большое значение для оценки случая. Для посева мокрота должна быть собрана в стерильную баночку, которая должна тотчас же после каждого выделения мокроты закрываться. Предварительно больному следует прополоскать рот свежекипяченой водой.
Опыты на животных . В случаях, где клиническая картина вызывает настойчивое подозрение на туберкулез, а ни бактериоскопическое исследование, ни посев не подтверждают диагноза, можно прибегнуть к заражению животного — биологическая проба. Оно оказывается необходимым, кроме того, в случаях, где бактериоскопическое исследование обнаруживает кислотоустойчивые палочки, а оснований подозревать туберкулез нет. Опыт производится на морских свинках.
Приготовление окрашивающих растворов
Карболовый генцианвиолет . 1 г генцианвиолета тщательно растирается в ступке с 5 г кристаллической карболовой кислоты и несколькими каплями чистого глицерина. При постоянном размешивании прибавляется понемногу 10 см3 96° спирта и так же осторожно 100 см3 дистиллированной воды. Краска оставляется в ступке на сутки, после чего фильтруется в соответственный флакон. Хорошо приготовленная окраска образует на поверхности золотистую пленку. Краска нестойка. Признаком ее порчи служит появление на стенках флакона мельчайших крупинок осадка.
Карболовый фуксин Циля приготовляется аналогично генцианвиолету по следующей прописи: фуксина (основного) 1,0, 96° спирта 10 см3, глицерина несколько капель, кристаллической карболовой кислоты 5 г, дистиллированной воды до 100 см3. Раствор очень стоек, может сохраняться долго.
Раствор Люголя . 2 г йодистого калия растворяются в 10 см3 дистиллированной воды, и туда прибавляется 1 г металлического йода. После полного растворения йода добавляется воды до 300 см3.
Страница 2 — 2 из 2
Начало | Пред. | 1 2 | След. | Конец
Консультант по гематологии,
цитохимии и микробиологии
Важное место в общем комплексе клинико-лабораторных исследований, применяемых для профилактики, диагностики и лечения гнойно-воспалительных заболеваний и осложнений у больных в лечебно-профилактических учреждениях занимают микробиологические исследования. Современная клиническая медицина предъявляет к микробиологическим (бактериологическим) исследованиям возрастающие требования по увеличению объема, повышению качества исследований, разработке и внедрению новых более совершенных методов. Это связано как с новыми научными достижениями в области эпидемиологии и бактериологии, так и с увеличением гнойно-воспалительных заболеваний, ростом госпитальных инфекций.
Материалом для изучения этиологии заболеваний дыхательных путей служат: отделяемое зева и носа; мокрота; содержимое бронхов, полученное при бронхоскопии или при отсасывании через трахеостому (у больных, находящихся на аппаратном дыхании); экссудаты; резецированные ткани и др. Материал собирают с соблюдением правил асептики в предварительно простерилизованные баночки или пробирки и доставляют в лабораторию. Хранение материала способствует размножению сапрофитирующей микрофлоры, развитию процессов гниения и брожения, что искажает результаты анализа. Интервал между взятием материала и его посевом не должен превышать 1-2 часа. Самым простым методом выявления микобактерий туберкулеза в выделениях больных является микроскопия мазка, приготовленного из мокроты. При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 — 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии.
Чувствительность метода люминесцентной микроскопии значительно выше — от 10 000 до 100 000 микобактерий в 1 мл материала, кроме того, этот метод дает возможность за значительно более короткое время просмотреть необходимое количество препаратов. Эффективность бактериоскопии повышается также при передаче изображения на компьютер при помощи присоединенной к микроскопу видеокамеры.
Чтобы диагностировать туберкулез, необходимо сделать все возможное для выявления возбудителя заболевания. Микробиологически диагноз может быть подтвержден на основе результатов культурального исследования на комплекс M. tuberculosis (или, при возможности, путем идентификации специфических последовательностей нуклеиновых кислот) в пробах, взятых в месте локализации патологического процесса. Однако на практике в настоящее время многие лаборатории не располагают материально-технической базой для проведения культуральных исследований. К счастью, микроскопия окрашенных препаратов мокроты доступна практически везде, поэтому диагностика туберкулеза может проводиться на основе выявления кислотоустойчивых микобактерий. На территориях с высокой распространенностью туберкулеза выявление кислотоустойчивых микобактерий в окрашенных препаратах мокроты демонстрирует высокую специфичность, поэтому положительный результат микроскопии мокроты можно рассматривать как подтверждение диагноза. Кроме высокой специфичности к комплексу M. tuberculosis, выявление кислотоустойчивых микобактерий при микроскопии играет важную роль по трем причинам: это – наиболее быстрый метод диагностики туберкулеза; позволяет выявить больных с тяжелым развитием патологии, чреватым высоким риском летального исхода; дает возможность выявить больных, являющихся распространителями инфекции.
Оценка качества работы лабораторий микроскопии должна проводиться соответствующим государственными органом (как правило, представителями национальной программы борьбы с туберкулезом).
Неправильный диагноз, поставленный перед началом лечения, приводит к риску ненужного, неправильного или неудачного лечения. Более того, подобный подход чреват несвоевременной постановкой правильного диагноза и назначением соответствующего лечения. При надлежащем подходе и контроле в большинстве случаев у детей в возрасте пяти лет и старше могут быть получены образцы мокроты. У подростков (хотя они часто относятся к детской возрастной группе, по крайней мере, до 15 лет) получить пробы мокроты не составляет большого труда. Поэтому фактор возраста не может рассматриваться как препятствие для сбора проб мокроты у детей и подростков.
Исходя из имеющихся данных, можно прийти к заключению, что для диагностики туберкулеза необходимо взять не менее двух проб мокроты. В случаях, когда имеются соответствующие возможности, можно направлять для лабораторного исследования еще и третью пробу, но исследование более трех проб мокроты вряд ли целесообразно, поскольку не может в значительной мере повысить эффективность диагностики. Кроме того, исследование третьей пробы может оказаться полезным только для подтверждения диагноза, если одна или две предыдущие пробы дали положительный результат. Крайне желательно, чтобы результаты микроскопии мокроты направлялись лечащему врачу в течение одного рабочего дня с момента отправки проб. Не меньшее значение имеет также и время сбора проб. Результаты исследований показывают, что эффективность лабораторных анализов максимальна, если пробы мокроты получены утром, после пробуждения от ночного сна. Возможно, совершенно необязательно собирать только утренние пробы, но, про крайней мере, одна из них должна быть получена утром.
Как правило, внелегочные очаги туберкулезного процесса содержат гораздо меньшее количество M. tuberculosis, поэтому микроскопическое выявление кислотоустойчивых микобактерий в пробах из внелегочных очагов весьма затруднено, и в таких случаях результаты культуральных исследований приобретают большое значение. Учитывая низкую результативность микроскопии, при внелегочном туберкулезе культуральные и морфологические исследования приобретают особое значение, например, в диагностическом исследовании проб ткани лимфатических узлов, полученных при помощи игловой биопсии.
Лечение пациентов, у которых наблюдаются тяжелое или быстро развивающееся заболевания, ассоциированные с туберкулезом, необходимо начинать немедленно, даже до лабораторного подтверждения диагноза. Лечение следует начинать до получения результатов лабораторного исследования и лишь позднее внести необходимые поправки и изменения в схему лечения с учетом результатов микроскопии.
Хотя микроскопия мокроты является наиболее доступным бактериологическим тестом, там, где ресурсы позволяют и имеются условия для качественной лабораторной диагностики, в диагностический алгоритм необходимо включать культуральные исследования мокроты, в случаях отрицательных результатов микроскопии. Правильное проведение культуральных исследований связано с определенными трудностями и дополнительными затратами, но этот метод отличается более высокой чувствительностью и повышает вероятность раннего выявления больных туберкулезом.
Микроскопия мазков мокроты по Циль-Нильсену является важнейшим элементом диагностики туберкулеза. Исследование 3 мазков мокроты позволяет выявить более 60% случаев туберкулеза легких и 95% наиболее заразных случаев (исследование одного мазка мокроты выявляет 75% наиболее заразных случаев, исследование второго мазка мокроты добавляет еще 20%, а исследование третьего — еще 5%).
Микроскопия мазков мокроты по Циль-Нильсену позволяет быстро получить результаты, выявить основные источники инфекции, является менее дорогостоящей, чем посев мокроты и широко доступна для применения. Но она должна быть надежной и хорошо контролироваться. Вероятность обнаружения МБТ при бактериоскопии мазков мокроты прямо пропорциональна концентрации возбудителя в исследуемом материале. Например, когда в 1 мл мокроты содержится от 1000 до 10000 МБТ, то вероятность получения положительного результата составляет около 40-50%. При концентрации МБТ менее 1000 в 1 мл мокроты вероятность их обнаружения резко снижается – отрицательные результаты получаются примерно в 96% случаев.
Основным и наиболее часто изучаемым биоматериалом в пульмонологической практике является мокрота. Требования к забору и качеству мокроты следующие:
1) первую пробу мокроты желательно получить до начала курса антибиотикотерапии;
2) мокроту оптимально собирать утром, до приема пищи, после тщательного туалета полости рта (полоскание кипяченой водой);
3) больным нужно доступно объяснить, что требуется получить именно содержимое нижних отделов дыхательных путей, а не ротоглотки, и, по возможности, проконтролировать их действия;
4) забор материала проводить в стерильные интактные контейнеры;
5) продолжительность хранения мокроты в контейнерах не должна превышать 2 ч (в летнее время желательно не более 1 ч);
6) в условиях лаборатории качество мокроты оценивается после окрашивания мазка по Граму (при наличии в мазке менее 25 лейкоцитов и более 10 эпителиальных клеток, при просмотре не менее 8-10 полей зрения при малом увеличении, мокрота признается некачественной, дальнейшее ее исследование нецелесообразно, так как, скорее всего, материал получен из ротовой полости);
7) высокая диагностическая ценность исследования признается при выделении возбудителя в концентрации і106 КОЕ/мл.
Вообще, в диагностике заболеваний туберкулезом можно выделить несколько этапов:
· Преаналитический этап (предварительный диагноз, выбор материала и метода исследования, забор биомтериала и его транспортировка)
· Аналитический этап (непосредственно проведение анализа)
· Постаналитический этап (оценка результатов)
Часть этих этапов проводится вне лаборатории, поэтому очень важна согласованная и качественная работа всех специалистов, привлеченных в этот процесс. Важен правильный выбор исследуемого материала. Важным этапом диагностики являются процедуры взятия и доставки материала в лабораторию.При взятии всех видов исследуемого материала следует ориентироваться на стандартные системы для этой цели: тампоны, цитощетки, тубсеры, контейнеры и т.п. Эффективность аналитического этапа во многом определяется уровнем технического оснащения лабораторий. Постаналитический этап исследования включает две составляющие: проверку достоверности полученного результата и оценку этиологической значимости выделенных штаммов. В лаборатории должен осуществляться строгий внутренний контроль качества исследований, важной составляющей которого является проверка полученных результатов на достоверность. Оценка этиологической значимости выделенных микроорганизмов принципиальна для выбора адекватной терапии. Процедура приготовления мазков начинается с подготовки предметных стекол. Необходимо использовать только новые, отмытые и обезжиренные в спирте или смеси для обезжиривания предметных стекол (производство АБРИС+) стекла без царапин и сколов. При повторном использовании стекла могут быть недостаточно хорошо отмыты от предыдущего материала, что может привести к получению ложноположительных результатов. Не рекомендуется использовать саморезанные стекла, которые приводят к значительным аберрациям исследуемого изображения. Стекла должны соответствовать ГОСТу. Стекла, на которых при микроскопическом исследовании были обнаружены кислотоустойчивые микобактерии, сохраняются в лаборатории в течение 1 года, а затем подлежат обязательному уничтожению и не должны использоваться повторно. Новые предметные стекла кипятят 15 минут в 1% растворе питьевой соды (10 г двууглекислого натрия на 1 л воды), промывают в 1% растворе соляной кислоты (к 1 л воды добавляют 10 мл концентрированной соляной кислоты), а затем промывают в проточной воде и протирают насухо.
Для обезжиривания вымытые и высушенные стекла помещают в герметически закрытые емкости со смесью для обезжиривания. Стекла должны подвергаться обезжириванию в течение суток. Непосредственно перед приготовлением мазков стекла повторно протираются насухо. Для окраски мазков, приготовленных непосредственно из диагностического материала (метод прямой микроскопии), наиболее часто используется метод Ziehl-Neelsen (Циль-Нильсен) (Реагенты — «Диахим» — набор для окраски по Циль-Нильсену»)..


