Антиген вируса простого герпеса
Содержание
Генитальный герпес
Лабораторная диагностика герпеса
Лабораторная диагностика герпеса проводится для выявления вируса простого герпеса (ВПГ). Инфекция ВПГ может вызывать небольшие болезненные пузырьки на коже или слизистых оболочках горла, носа, полости рта, уретры, анального отверстия и влагалища. Инфекция герпеса может вызвать всего одну вспышку герпетических высыпаний, однако в большинстве случаев инфицированный испытывает периодические рецидивы.
Существует два вида ВПГ.
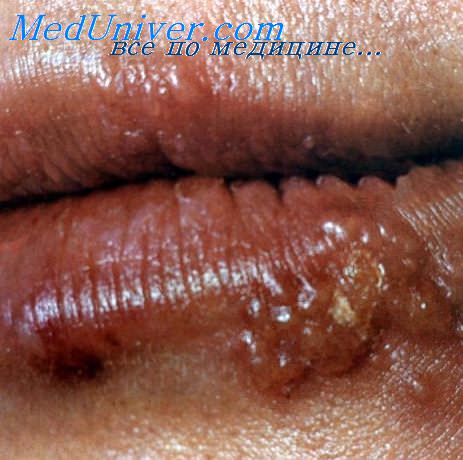
ВПГ 1-го типа вызывает пузырьковый лишай (его также называют лихорадкой) на губах. ВПГ-1 обычно передается через поцелуи или совместное использование столовых принадлежностей (ложек или вилок) с человеком, имеющим герпетические высыпания на губах. ВПГ-1 также может вызывать высыпания в области гениталий.
ВПГ 2-го типа вызывает пузырьковые высыпания в области гениталий (генитальный герпес), поражающие пенис или влагалище. ВПГ-2 также вызывает инфекцию герпеса у новорожденных, которые появились на свет в процессе родов естественным путем от женщин, имеющих генитальный герпес в активной фазе. ВПГ-2 обычно передается половым путем. Иногда ВПГ-2 может вызывать герпес губ.
В редких случаях ВПГ может поражать другие части тела, например, глаза или мозг.
Анализы на герпес чаще всего проводятся в случае высыпаний в области гениталий. Иногда для исследований могут браться пробы спинномозговой жидкости, крови, мочи или слез. Для того чтобы выяснить, вызваны ли высыпания вирусом простого герпеса, проводятся различные исследования.
Вирусологический посев. Образцы клеток или жидкости из герпетических язвочек собираются на ватный валик, и производится выделение герпеса на культуре клеток. Вирусологический посев – лучший метод выделения инфекции генитального герпеса, однако зачастую этот метод диагностики не позволяет обнаружить вирус, даже если он присутствует (ложноотрецательный результат).
Выявление антигена вируса герпеса. Берется соскоб образцов клеток из свежих пузырьков, который затем помещается на предметное стекло микроскопа. Это исследование выявляет маркеры (которые называются антигенами) на поверхности клеток, инфицированных вирусом герпеса. Это исследование проводится совместно с посевом на культуре клеток, или вместо него.
Полимеразная цепная реакция (ПЦР). Исследование методом ПЦР может проводиться на образцах клеток или жидкости из язвочек, а также на образце крови, либо спинномозговой жидкости. ПЦР выявляет генитический материал (ДНК*) ВПГ. Это исследование может определять, какой именно тип вируса, ВПГ-1 или ВПГ-2, присутствует в организме тестируемого. Для метода ПЦР редко используют соскобы с высыпаний, а наилучшим объектом исследования считается спинномозговая жидкость, особенно в случаях, когда существует подозрение, что герпес поражает мозг или ткани вокруг него.
Анализы на антитела к герпесу. Анализы крови могут выявить антитела, вырабатываемые иммунной системой для борьбы с инфекцией герпеса. Тесты для выявления антител к герпесу время от времени проводятся, однако, они не так точно, как вирусологические посевы, позволяют определить причины высыпания. Анализы на антитела не показывают разницы между инфекцией герпеса, активной на данный момент, и инфекцией герпеса, которая была активной в прошлом. Поскольку должно пройти некоторое время с момента инфицирования прежде, чем появятся антитела к герпесу, если вы заразились недавно, велика вероятность того, что результаты анализа будут ложноотрицательными. Некоторые анализы крови могут определять различие между ВПГ-1 и ВПГ-2.
Принято считать, что примерно половина взрослого населения Украины имеют антитела к герпесу.
Инфекцию герпеса невозможно вылечить. Однажды заразившись, вы останетесь носителем вируса до конца жизни. Он «прячется» в нервных клетках, и у некоторых людей вызывает больше рецидивов, чем у других. Повторные вспышки заболевания могут быть спровоцированы стрессом, усталостью, солнечным светом, или другой инфекцией, например, простудой или гриппом. Лекарства могут облегчить симптомы и уменьшить их продолжительность, однако, не могут раз и навсегда вылечить человека от этого заболевания.
Одна из разновидностей вируса герпеса (под названием вирус ветряной оспы) вызывает ветряную оспу и опоясывающий лишай.
Анализ на герпес — особенно важен во время беременности
Особенно важно выявить наличие герпеса в период подготовки к беременности или во время беременности, так как все герпетические инфекции относятся к ТОРЧ-инфекциям – заболеваниям, способным вызывать тяжелые осложнения со стороны плода во время внутриутробного развития.
Именно поэтому специалисты рекомендуют женщине планировать беременность с проведением предварительного обследования за несколько месяцев до зачатия. Особенностью герпетической инфекции является то, что наиболее опасным для плода является первичное заражение во время беременности. Если же инфекция принимает хронический характер, опасность заражения значительно снижается.
Какие анализы сдают на герпес
Для получения достоверных данных лабораторная диагностика герпеса должна включать сочетание не менее двух методов исследования. Диагноз герпеса I и II типов подтверждается следующими двумя типами анализов:
- ПЦР (полимеразной цепной реакцией), которая со 100% гарантией обнаруживает в организме гены ВПГ – I и ВПГ II;
- ИФА (иммуно-ферментным анализом) – выявляются антитела к ВПГ – I и ВПГ II.
Анализ на герпес методом ПЦР
Методом ПЦР можно определить наличие вируса герпеса в крови или в соскобах со слизистых оболочек или кожи при обострении заболевания.
При острой первичной герпетической инфекции, вызванной ВПГ – I и ВПГ II, вирус можно обнаружить в клетках пораженной кожи и слизистых оболочек в течение недели после первых проявлений инфекции, а при вторичном обострении (рецидиве) – в течение четырех дней. При нарушениях иммунитета этот срок может длиться до 20 дней.
Таким образом, обнаружение ВПГ – I и ВПГ II в клетках кожи и слизистых оболочек (положительный анализ на герпес) говорит об остром инфекционном процессе. Но положительные результаты анализов на герпес методом ПЦР не позволяют установить, является ли этот процесс первичным или вторичным.
Анализ крови на герпес методом ИФА
ИФА – это анализ крови на вирус герпеса, позволяющий выявлять в крови антитела к ВПГ – I и ВПГ II, но и определять их количество. Анализ на герпес – расшифровка ИФА крови позволяет дифференцировать первичный процесс от вторичного. При первичном заражении в течение первой недели появляются антитела класса М (иммуноглобулины М – IgM), их число достигает максимума к второй-третьей неделе заболевания. IgM исчезают через 2–3 месяца после начала заболевания. У некоторых больных их можно обнаружить и при рецидиве хронической инфекции. Со второй недели заболевания в крови начинают появляться антитела к ВПГ – I и ВПГ II класса G (иммуноглобулины G – IgG), которые остаются в крови больного на всю жизнь.
Большое значение имеет определение степени авидности (прочности связи с антигеном, то есть с вирусом герпеса) IgG. При первичном заражении степень авидности IgG низкая и только через несколько месяцев после заражения авидность IgG становится высокой. Это позволяет с высокой степенью достоверности определить, является ли острая герпетическая инфекция первичной или рецидивом хронического процесса.
Сдать анализ на герпес можно в лабораториях ООО «Инвитро», которые имеют филиалы во многих городах России. Анализ на герпес Инвитро проводится на современном уровне и позволяет точно определить стадию инфекционного процесса.
Диагностика герпеса
Ранняя и точная диагностика заболеваний крайне важна для своевременного назначения адекватного лечения, это справедливо и для герпевирусных инфекций. Зачастую характерной клинической картины бывает достаточно, чтоб поставить диагноз простого герпеса: за несколько часов до появления высыпаний в области губ или носа появляются продромальные симптомы – зуд и жжение, с последующим образованием на этом месте характерных пузырьков, заполненных прозрачной жидкостью. Гораздо сложнее поставить диагноз при атипичных случаях заболевания, при поражении гениталий, внутренних органов либо при генерализованном герпесе.
 В таких случаях нельзя обойтись без лабораторного подтверждения герпевирусной инфекции.
В таких случаях нельзя обойтись без лабораторного подтверждения герпевирусной инфекции.
Существует несколько методов диагностики вирусных инфекций, их можно разделить на 3 группы:
— выделение вируса и его идентификация (определение вида);
— определение вирусной ДНК;
— определение в сыворотке крови антител к антигенам вируса.
Вирусы относятся к облигатным внутриклеточным паразитам, то есть весь их жизненный цикл проходит внутри клетки. В связи с этим процесс выделения и идентификации вируса представляет значительные трудности, и для диагностики вирусных инфекций в медицинской практике применяется крайне редко.
Широко используются для диагностики герпеса серологические методы (от лат.serum — сыворотка), основанные на обнаружении в сыворотке крови антител к антигенам вируса. Один из наиболее распространенных серологических методов — иммуноферментный анализ (ИФА). Антителами к антигенам вируса простого герпеса являются иммуноглобулины классов М и G (IgM и IgG). Причем важно не столько само наличие специфических иммунонглобулинов, сколько их соотношение и прирост. Так, через 2-3 недели после заражения вирусом герпеса в крови появляются IgM; после первичного проявления герпевирусной инфекции и в дальнейшим при ее рецидивах появляются IgG. Эту информацию используют врачи для оценки состояния противовирусного иммунитета и решения вопроса о необходимости назначения специфического лечения.
Например, если в сыворотке крови обнаружены IgM при отсутствии IgG, это свидетельствует о первичном инфицировании. В таких случаях беременным женщинам назначают специфическую терапию, поскольку риск инфицирования плода крайне высок. Если же обнаружены IgG к вирусу герпеса, а IgM отсутствуют или их титр невысок — это означает, что инфицирование произошло давно, иммунитет к вирусу герпеса выработался, рецидив заболевания возможен лишь при снижении иммунитета, в специфическом лечении нет необходимости.
Для более достоверной диагностики ИФА проводится методом парных сывороток: забор крови производят дважды с интервалом 2-3 недели. Если во втором образце сыворотки обнаруживают нарастание титра IgG в 4 и более раз, это свидетельствует о первичном инфицировании. При одновременном выявлении IgG и IgM и отсутствии или незначительном нарастании титра IgG в повторно взятом образце можно думать об обострении хронического рецидивирующего герпеса. 1
ИФА чаще других методов применяется для диагностики вирусных инфекций, поскольку является относительно простым и дешевым, однако он не позволяет различить, каким типом вируса простого герпеса вызвано заболевание: ВПГ-1 или ВПГ-2.
Установить это возможно с помощью определения антигенов вируса, для чего применяется полимеразная цепная реакция (ПЦР). Для исследования с помощью ПЦР нужен биологический материал, содержащий вирус. Для этого проводят забор спинномозговой жидкости (при подозрении на поражение ЦНС), крови (при генерализованном герпесе), иногда берут материал из язвочек на коже и слизистых. Метод основан на определении вирусной ДНК в исследуемом материале. Метод ПЦР очень чувствителен (достаточно одной молекулы ДНК для ее обнаружения) и высокоспецифичен (обнаруживает именно ту вирусную ДНК, которая задана исследователем). Однако он является качественным, а не количественным, т.е. не дает представления о количестве вирусных ДНК во взятом материале. ПЦР – достаточно дорогостоящий метод, поэтому не используется для рутинной диагностики, а назначается только в тяжелых диагностических случаях.
Гораздо меньшее практическое значение имеют другие методы диагностики герпевирусной инфекции: вирусологический, биологический, цитологический. При вирусологическом методе вирусом из пораженных тканей заражают клеточные культуры, в дальнейшем наблюдают характерные поражения клеток. Биологический метод основан на появлении характерных изменений на роговице кролика при заражении его вирусным материалом, взятым из пораженных тканей больного. При цитологическом исследовании пораженных тканей под микроскопом обнаруживают специфические клетки, которые образуются под воздействием вируса герпеса .
1 Данная информация приводится для примера того, как оцениваются результаты ИФА и не является основанием для самостоятельной диагностики заболевания.
Основным протективным антигеном вируса простого герпеса типа I и II (ВПГ-1, ВПГ-2) является гликопротеин Д (gD), и в меньшей степени — гликопротеин B(gB).
Очищенный gD ВПГ-1 или ВПГ-2 защищает мышей от летальной дозы как ВПГ-1, так и ВПГ-2; стимулирует образование ВН-антител, пассивное введение которых защищает мышей от летальной инфекции ВПГ; стимулирует комплементзависимую и опосредованную антителами цитотоксичность. Комбинация обоих гликопротеинов (gD и gB) усиливает протективную активность препарата. В четырех антигенных участках gD ВПГ-1 различают по крайней мере шесть эпитопов. Антитела к большинству из них нейтрализуют вирус без участия комплемента и подавляют проникновение вируса в клетку. Нейтрализация вируса и индукция протективного иммунитета приводили к активизации гуморальных и клеточных факторов иммунитета у мышей и кроликов, повышали их резистентность к экспериментальному заражению и снижали количество клеток ганглия тройничного нерва, несущих геном вируса. Нейтрализация вируса и индукция протективного иммунитета связаны с аминокислотными остатками 233-259, а адсорбция вируса — с областью в пределах первых 182 аминокислот. Точечные мутации в сайте нейтрализации gD могут сделать его нечувствительным к действию ВН-антител.
Слияние вирусной и клеточной оболочек ВПГ-1 определяет gB. За аналогичные функции вируса Эпштейн-Барра ответственны два гликопротеина (220/200 и 350/300 кД), расположенные на поверхности вириона. Эти белки вызывали у кроликов образование антител, реагирующих с одними и теми же белками на поверхности вирионов и инфицированных вирусом клеток. Вакцина, содержащая гликопротеин 340 кД, вызывала иммунитет у обезьян. В нейтрализации цитомегаловируса и выработке нейтрализующих антител основная роль принадлежит гликопротеинам 86 и 130/55 кД.
В оболочке вируса псевдобешенства (ВПБ) различают три основных гликопротеина (gE, gB, gX), кодируемых u-сегментом вирусного генома. При иммунном ответе свиней на инфекцию защитные антитела формируются к двум гли-копротеинам: gE и gB. Гликопротеин gE состоит из двух субъединиц с массой около 80 кД. Он не является существенным для репликации, поскольку известны вакцинные штаммы с делениями в этой области генома. N-концевой фрагмент gE содержит высокоантигенный домен, способный вызвать образование НВ-антител и защитный эффект. Делеция по гену gE может привести к снижению иммунногенности, чего не наблюдается при удалении гена gX. Предшественники gII и gIII имеют соответственно молекулярную массу 110 и 60 кД. За слияние вирусной и клеточной оболочек и проникновение вируса в клетку ответственен gB. Антигенного дрейфа в gB и gE не обнаружено.
Однако основную роль в индукции синтеза нейтрализующих антител ВПБ, проявляющих активность в отсутствие комплемента, играет gB. Являясь мультифункциональным белком, он, кроме того, играет важную роль в адсорбции и эффективной репликации вируса в культуре клеток. Антитела к gIII обладали более выраженным защитным эффектом у мышей (90-100%) и свиней (84-100%), чем к gII. Гликопротеин gIII играет определяющую роль в клеточном иммунитете, поскольку является главным антигеном-мишенью для вирусспецифических цитотоксических Т-лимфоцитов. Кроме gill, заметная роль в защите вакцинированных животных принадлежит g50 кД, который также является основной мишенью ВН-антител. Следует отметить, что пассивная защита поросят не предотвращала репликацию и экскрецию ВПБ в назофаренгиальной области зараженных животных. Титр нейтрализующих антител in vitro не всегда коррелировал с защитой животных.
Так как все полевые штаммы ВПБ содержат gE, а большинство аттенуированных штаммов, используемых в качестве живых вакцин, не содержат gE, появилась возможность использовать ИФА для дифференциации иммунных и инфицированных животных и тем самым способствовать оздоровлению хозяйств на основе вакцинопрофилактики. Указанная стратегия успешно реализуется в практических условиях в Западной Европе.
За индукцию синтеза ВН-антител герпесвируса типа I крупного рогатого скота (ГВ I) ответственны четыре гликопротеина оболочки. Главными из них являются g70 и g97. Эти гликопротеины содержат основные эпитопы нейтрализации вируса. Гемагглютинирующая активность ГВ крупного рогатого скота связана с мажорным g97, расположенным в шипиках вириона. Главные нейтрализующие эпитопы расположены на гемагглютинирующем домене, что свидетельствует о перспективности использования гемагглютинирующего антигена ГВ 1 крупного рогатого скота для приготовления субъединичной вакцины, 15381. ГВ1 крупного рогатого скота так же, как герпесвирус типа I кошек (ГВК1), агглютинирует эритроциты мышей, хотя гемагглютинирующие домены этих вирусов не идентичны.
В структуре gIV ГВ1 крупного рогатого скота идентифицированы три нейтрализующих домена. Домен I содержит два перекрывающихся эпитопа, домен III — четыре идентичных или перекрывающихся эпитопа, домен II — один эпитоп. Домен I имеет отношение к проникновению вируса в клетки-мишени. Прикрепление вируса к клеткам in vitro опосредовано его главными гликопротеинами, которые в этом отношении можно расположить в ряду gill > gl > gIV. Очищенный gIII полностью блокирует адсорбцию полевого штамма ГВ1 крупного рогатого скота.
В становление гуморального и клеточного иммунитетов свой вклад вносят гликопротеины оболочки gI gIII и особенно gIV. Максимальную защиту телят в экспериментальных условиях обеспечивал gIV, а также безвирусный лизат инфицированных клеток.
Нейтрализующие антитела к трем оболочечным гликопротеинам (gI, gIII и gIV) FBI крупного рогатого скота вводили телятам и определяли защитный эффект при экспериментальном заражении гомологичным вирусом. У привитых животных титры антител в носовом секрете и смывах с конъюнктивы были аналогичны таковым у реконвалесцентов. Несмотря на клинический эффект от введения антител, они не предотвращали размножение ГВ1 крупного рогатого скота в слизистой оболочке носа и глаз, а также не сокращали его экскрецию. Цитотоксические Т-лимфоциты крупного рогатого скота, индуцированные ГВ1 крупного рогатого скота, проявляют специфичность, то есть реагируют только на клетки, экспрессирующие гомологичный или родственный антиген. Мутант ГВ1 крупного рогатого скота с делецией гена gIII не теряет способности размножаться в культуре клеток. Его функциональная дефектность проявляется в замедленной адсорбции и репликации, а также в снижении выхода внеклеточного вируса. По аналогии с вирусом псевдобешенства идентифицированы и делетированы несущественные гены с целью получения аттенуированных «маркированных» вакцин.
— Вернуться в оглавление раздела "Микробиология."
Вирус простого герпеса (ВПГ) – ДНК–содержащий вирус Herpes simplex virus семейства Herpesviridae подсемейства Alphaherpesvirinae. Согласно статистическим данным ВОЗ, инфекции, обусловленные ВПГ, занимают второе место по распространенности среди вирусных заболеваний человека. Различают два серотипа ВПГ – ВПГ-1 и ВПГ-2. Оба типа вируса вызывают инфекционные заболевания человека различной степени тяжести от характерных везикулезных или пустулезных высыпаний на коже и слизистых до поражений ЦНС. ВПГ-1 – причина офтальмогерпеса, протекающего в форме кератита или кератоиридоциклита, реже увеита, в единичных случаях — ретинита, блефароконъюнктивита. Заболевание может привести к помутнению роговицы и вторичной глаукоме. ВПГ-1 — основная причина энцефалита у взрослого населения стран умеренного климата, при этом только у 6–10% больных отмечается одновременное поражение кожи.
В ходе проведения эпидемиологических исследований установлено наличие специфических АТ к ВПГ у 90–95% обследуемых лиц среди взрослого населения, при этом первичная инфекция манифестно протекает лишь у 20–30% инфицированных.
ВПГ характеризуется коротким циклом репродукции в клеточных культурах и оказывает сильное цитопатическое действие. Он способен к репродукции в различных типах клеток, чаще персистирует в ЦНС, преимущественно в ганглиях, поддерживая латентную инфекцию с возможностью периодической реактивации. Наиболее часто вызывает кожно-слизистые формы заболевания, а также поражение ЦНС и глаз. Геном ВПГможет интегрироваться с генами других вирусов (включая ВИЧ), вызывая их активацию, также возможен его переход в активное состояние на фоне развития иных вирусных и бактериальных инфекций.
Пути передачи ВПГ: воздушно-капельный, половой, контактно-бытовой, вертикальный, парентеральный. Факторами передачи ВПГ служат кровь, слюна, моча, везикулярный и вагинальный секрет, сперма. Входными воротами являются поврежденные слизистые оболочки и кожа. По периферическим нервам вирус доходит до ганглиев, где сохраняется пожизненно. При активации ВПГ распространяется по нерву к первоначальному очагу поражения (механизм “замкнутого цикла” – циклическая миграция вируса между ганглием и поверхностью кожи). Может происходить лимфогенная и гематогенная диссеминация возбудителя, что особенно характерно для недоношенных новорожденных и лиц с выраженным иммунодефицитом (в т. ч. при ВИЧ-инфекции). ВПГ обнаруживается на лимфоцитах, эритроцитах, тромбоцитах, при проникновении вируса в ткани и органы возможно их повреждение вследствие его цитопатического действия. Сохраняющиеся в течение всей жизни у человека вируснейтрализующие АТ (даже в высоких титрах), хотя и препятствуют распространению инфекции, но не предупреждают рецидивов.
Выделение ВПГ продолжается значительное время при первичном инфицировании (ДНК выявляется в плазме крови в течение 4–6 недель), при рецидивах – не более 10 дней. Формирование противогерпетического иммунитета происходит как при манифестном, так и при бессимптомном течении инфекции. При первом контакте АГ с клетками иммунной системы в течение 14–28 дней формируется первичный иммунный ответ, который у иммунокомпетентных лиц проявляется образованием интерферонов, выработкой специфических АТ (вначале – IgM, впоследствии – IgA и IgG), повышением активности естественных киллеров – NK-клеток и формированием мощного пула высокоспециализированных киллеров. В случае реактивации или реинфекции возникает повторный контакт клеток иммунной системы с АГ, образуются АТ и Т-киллеры. Реактивация сопровождается продукцией АТ IgM (редко даже при наличии типичных высыпаний), АТ IgА (чаще) и IgG.
ВПГ (преимущественно ВПГ-2) вызывает генитальный герпес – хроническое рецидивирующее заболевание. Клинические проявления первичного эпизода инфекции, вызванной разными типами вируса сходны, однако инфекции, вызванной ВПГ-2, в гораздо большей степени свойственен рецидивирующий характер. Передача вируса происходит при половых контактах, очаг инфекции локализуется на слизистой и коже половых органов и перигенитальной зоны. Размножение вируса в клетках эпителия приводит к образованию очага сгруппированных пузырьков (папул, везикул), в которых содержатся вирусные частицы, сопровождается покраснением, зудом. Первичный эпизод протекает острее (обычно с симптомами интоксикации), чем последующие рецидивы. Часто возникают симптомы дизурии, признаки эрозии шейки матки.
На ранних стадиях ВИЧ-инфекции течение заболеваний, вызванных ВПГ-1 или ВПГ-2, короткое и типичное. Частым признаком углубления иммуносупрессии и перехода латентной стадии ВИЧ-инфекции в стадию вторичных заболеваний служит развитие опоясывающего лишая. Наличие стойких глубоких вирусных поражений кожи, повторный или диссеминированный опоясывающий лишай, локализованная саркома Капоши — одни из клинических критериев стадии вторичных заболеваний ВИЧ-инфекции. У больных с количеством CD4+-клеток менее 50 клеток/мкл отсутствует тенденция к самостоятельному заживлению эрозивно-язвенных дефектов. Частота герпетического энцефалита среди поражений ЦНС при ВИЧ-инфекции — около 1–3%. У больных СПИДом с наличием глубокого иммунодефицита заболевание нередко протекает атипично: болезнь начинается подостро и медленно прогрессирует до тяжелейших проявлений энцефалита.
Герпетическая инфекция даже при бессимптомном течении способна вызвать целый ряд патологий у беременной и новорожденного. Наибольшую угрозу репродуктивной функции представляет генитальный герпес, который в 80% случаев обусловлен ВПГ-2 и в 20% – ВПГ-1. Бессимптомное течение чаще имеет место у женщин и более типично для ВПГ-2, чем для ВПГ-1. Первичное инфицирование или рецидивы во время беременности наиболее опасны для плода, поскольку могут привести к самопроизвольному выкидышу, гибели плода, мертворождению, порокам развития. Заражение плода и новорожденного чаще отмечается при бессимптомном течении генитального герпеса, чем при клинически выраженном типичном течении. Новорожденный может приобрести герпетическую инфекцию внутриутробно, во время родов (в 75–80% случаев), либо постнатально.
ВПГ-2 может проникать в полость матки через цервикальный канал с поражением плода в 20–30% случаев; трансплацентарное инфицирование может происходить в 5–20% случаев, инфицирование во время родов – в 40% случаев. Возможна передача вируса при выполнении медицинских процедур. При типичных клинических проявлениях диагноз герпетической инфекции трудностей не представляет, тогда как при атипичных формах верифицируется на основании результатов лабораторных исследований, при этом приоритетными должны быть исследования, направленные на выявление маркеров текущей (активной) инфекции. Активация инфекционного процесса при герпетической инфекции, даже при наличии клинических проявлений в стадии обострения, редко сопровождается выработкой АТ-ВПГ IgM (чаще – при первичной инфекции либо реинфекции), как правило, при этом отмечают появление АТ-ВПГ IgА.
Целесообразными являются диагностические исследования для обнаружения ВПГ или его маркеров при наличии в анамнезе пациента указаний на рецидивирующую инфекцию либо на дебют герпетической инфекции в период беременности.
Дифференциальная диагностика. При наличии инфекционного синдрома (длительный субфебрилитет, лимфаденопатия, гепато- или гепатоспленомегалия) – токсоплазмоз, цитомегаловирусная инфекция и инфекция, вызванная ВЭБ; контактный дерматит, инфекционные заболевания, сопровождающиеся везикулезными высыпаниями на коже и слизистых оболочках (ветряная оспа, опоясывающий герпес, пиодермия и др.); эрозивно–язвенные поражения гениталий, обусловленные Treponema pallidum, Haemophilus ducreyi; болезнь Крона, синдром Бехчета, фиксированная токсикодермия, менингоэнцефалиты и менингиты неясной этиологии, увеиты и кератоконъюнктивиты неясной этиологии).
Показания к обследованию
- Планирование беременности;
- женщины, имеющие в анамнезе либо на момент обращения типичные герпетические высыпания любой локализации, в т. ч. рецидивирующий генитальный герпес, или наличие пузырьковых и/или эрозивных высыпаний на коже, ягодицах, бедрах, слизисто–гнойные выделения из влагалища;
- наличие полового контакта с партнером, имеющим генитальный герпес;
- атипичная форма заболевания: отсутствие зуда или жжения, отсутствие везикул, веррукозные узелки; обширные кожные поражения (до 10% случаев предполагаемого опоясывающего герпеса обусловлено не ВЗВ, а ВПГ);
- женщины с отягощенным акушерским анамнезом (перинатальные потери, рождение ребенка с врожденными пороками развития);
- беременные женщины (в первую очередь имеющие УЗИ-признаки внутриутробной инфекции, лимфоаденопатии, лихорадку, гепатит и гепатоспленомегалию неясного генеза);
- дети с признаками внутриутробной инфекции, врожденными пороками развития или наличием на коже или слизистых оболочках везикул или корочек;
- дети, рожденные от матерей, перенесших генитальный герпес во время беременности;
- ациенты (в первую очередь новорожденные) с сепсисом, гепатитами, менингоэнцефалитом, пневмонией, поражением глаз (увеит, кератит, ретинит, ретинальный некроз), поражением ЖКТ.
Материал для исследования
- Содержимое пузырьков/везикул со слизистых оболочек и кожи половых органов мужчин и женщин – микроскопические исследования, культуральные исследования, выявление АГ, выявление ДНК;
- мазки (соскобы) со слизистых оболочек цервикального канала, уретры (при отсутствии видимых пузырьковых высыпаний или эрозивно-язвенных поражений) – выявление ДНК;
- сыворотка крови, СМЖ (по показаниям) – выявление АТ.
Этиологическая лабораторная диагностика включает микроскопическое исследование, выделение и идентификация вируса в культуре клеток, выявление АГ или ДНК возбудителя, определение специфических АТ.
Сравнительная характеристика методов лабораторной диагностики (вирус простого герпеса — анализ). Среди методов лабораторной диагностики “золотым стандартом” долгое время считали выделение ВПГ в культуре клеток из крови, СМЖ, содержимого везикулезных или пустулезных высыпаний и других локусов (носоглотки, конъюнктивы, уретры, влагалища, цервикального канала). Данный метод предполагает изоляцию вируса при заражении биологическим материалом чувствительных культур клеток с его последующей идентификацией. К неоспоримым преимуществам метода относятся: возможность определения активности инфекции при наличии клинических проявлений и проведения типирования вируса, а также установления чувствительности к противовирусным препаратам. Однако длительность анализа (1–8 дней), трудоемкость, высокая стоимость и необходимость определенных условий проведения исследований затрудняет применение данного метода для рутинной лабораторной диагностики заболевания. Чувствительность достигает 70–80%, специфичность – 100%.
Материал с поверхности высыпаний может быть использован для микроскопических (окраска препаратов по Романовскому–Гимзе) или цитологических (окраска препаратов по Тцанку и Папаниколау) исследований. Названные процедуры имеют низкую диагностическую специфичность (не позволяют дифференцировать ВПГ от других герпес-вирусов) и чувствительность (не более 60%), поэтому не могут считаться надежными методами диагностики.
Выявление АГ ВПГ в крови, СМЖ, содержимом везикулезных или пустулезных высыпаний и других локусов (носоглотки, конъюнктивы, уретры, влагалища, цервикального канала) проводят методами РИФ и РНИФ с использованием моноклональных или высокоочищенных поликлональных АТ. При использовании метода ИФА чувствительность исследования возрастает до 95% и более, специфичность при манифестном герпесе варьирует от 62 до 100%. Однако большинство наборов реагентов для выявления антигена ВПГ методом ИФА не позволяют провести дифференцирование серотипов вируса.
Обнаружение ДНК ВПГ-1 и/или ВПГ-2 при использовании ПЦР в различном биологическом материале превосходит чувствительность обнаружения ВПГ при использовании вирусологического исследования. Выявление ВПГ в соскобах со слизистых оболочек полости рта, урогенитального тракта, в отделяемом пузырьковых высыпаний (везикул) и эрозивно–язвенных поражений кожи с помощью ПЦР является методом выбора. Несомненную ценность имеет определение количества ДНК ВПГ методом ПЦР в режиме реального времени, результаты исследования можно использовать как с диагностической целью, так и для оценки эффективности лечения.
Для выявления АТ к ВПГ разных классов IgА, IgG, IgM, суммарных к антигенам ВПГ обоих типов или типоспецифичных, применяют методы РНИФ или ИФА, для определения авидности АТ IgG – метод ИФА. Наибольшее диагностическое значение имеет детекция АТ IgM как показателя активности процесса, их выявление может свидетельствовать об остром заболевании, реинфекции, суперинфекции или реактивации. Однако в клинически выраженных случаях, в т. ч. при типичном течении генитального или неонатального герпеса, специфические АТ IgM выявляются редко (в 3–6% случаев). Определение авидности АТ-ВПГ IgG несет низкую информационную нагрузку: реактивация при клинически выраженных случаях сопровождалась наличием высокоавидных АТ. Тест на выявление АТ-ВПГ IgА является методом выбора наряду с определением ДНК либо АГ ВПГ при определении активности инфекционного процесса.
Показания к применению различных лабораторных исследований. Определение АТ целесообразно проводить для подтверждения первичной инфекции, а также установления диагноза у пациентов с бессимптомным и атипичным течением заболевания.
У беременных женщин (скрининг) целесообразно проведение исследований для выявления АТ-ВПГ IgМ, а также выявление АТ-ВПГ IgА. Для беременных высокого инфекционного риска дополнительно рекомендуется определение ДНК и АГ ВПГ в лейкоцитарной взвеси или в материале из предполагаемого очага.
При подозрении на внутриутробную инфекцию рекомендуется выявление ДНК вируса в пуповинной крови, у новорожденных – детекция ДНК вируса в различных биологических пробах (отделяемое пузырьковых высыпаний (везикул) эрозивно– язвенных поражений кожи и слизистых оболочек, ротоглотки, конъюнктивы; периферическая кровь, СМЖ, моча и др.), а также определение АТ-ВПГ IgМ и IgА в крови. Учитывая высокую диагностическую значимость определения ДНК вируса методом ПЦР и наличие зависимости между летальностью у новорожденных и виремией, вызванной ВПГ, некоторые исследователи рекомендуют использовать этот метод для лабораторного скрининга генерализованной герпетической инфекции детей, относящихся к группе высокого риска.
Выявление АГ-ВПГ в различных биологических пробах предлагается применять в качестве экспресс-тестов для дифференцирования типов вируса при скрининге популяций с высоким уровнем заболеваемости, а также при мониторинге заболевания.
У больных ВИЧ-инфекцией с атипичными клиническими проявлениями кожных поражений в диагностике отдается предпочтение выявлению ДНК ВПГ методом ПЦР как самому чувствительному методу лабораторной диагностики.
Особенности интерпретации результатов. Обнаружение вирусоспецифических АТ IgM может свидетельствовать о первичной инфекции, реже – о реактивации или реинфекции, выявление АТ-ВПГ IgА – об активности инфекционного процесса (затяжное течение при дебюте герпетической инфекции, реинфекции или реактивации). О врожденной инфекции (неонатальный герпес) свидетельствует присутствие АТ-ВПГ IgM и(или) IgА. Выявление АТ IgG отражает латентную инфекцию (инфицирование).
Выявление ДНК ВПГ свидетельствует о наличии активной (репликативной) стадии вирусной инфекции с учетом выраженности клинических проявлений. Выявление ДНК ВПГ-1 и/или ВПГ-2 методом ПЦР позволяет при однократном тестировании установить факт внутриутробного инфицирования плода; при проведении обследования в первые 24–48 ч после рождения лабораторно подтвердить врожденную инфекцию, вызванную ВПГ.
Диагностическое значение (специфичность и чувствительность) обнаружения ДНК ВПГ в СМЖ у больных ВИЧ-инфекцией с поражением ЦНС окончательно не установлены. Возможно, для подтверждения герпетической этиологии энцефалита необходимо определение концентрации ДНК ВПГ в СМЖ. Исследование для обнаружения ДНК ВПГ в крови малоинформативно в связи кратковременным нахождением ВПГ в сосудистом русле, следовательно, возможно получение отрицательного результата несмотря на развитие клинически выраженного заболевания.
Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 — 2019
Центральный офис: 111123, Россия, Москва, ул. Новогиреевская, д.3а, метро "Шоссе Энтузиастов", "Перово"
+7 (495) 788-000-1, info@cmd-online.ru

! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.


