Вич поражает т хелперы
Содержание
- 1 Структура ВИЧ
- 2 Белки ВИЧ
- 3 Какие клетки поражаются вирусом?
- 4 Репликация ВИЧ
- 5 Симптомы
- 6 Основной удар по иммунной системе
- 6.1 Взаимодействие ВИЧ с моноцитами
- 6.2 Взаимодействие вируса с макрофагами
- 6.3 Гибель CD-4 клеток
- 6.4 Взаимодействие вируса с дендритными клетками
- 6.5 Патогенез повреждения мозга при недуге
- 6.6 Патогенез поражения лимфоидной ткани при ВИЧ
- 6.7 Поражение ЦНС (Центральной нервной системы)
- 6.8 Поражение других органов и систем
- 7 Профилактические меры
- 8 Лечение
- 9 Конкурс «био/мол/текст»-2013
- 10 Иммунная система
- 11 Жизненный цикл ВИЧ
- 12 Способы уничтожения иммунной системы
- 13 Пути заражения ВИЧ
- 14 Заключение
ВИЧ – самая опасная новая болезнь современности, которая на сегодняшний день не поддается лечению. Для выяснения причины обстоятельств необходимо определить, какие клетки поражает инфекция ВИЧ. В первую очередь, влиянию подвергается иммунная система человека, по мере дальнейшего развития ВИЧ поражаются внутренние органы больного. Как только после заражения вирусом наблюдается поражение жизненно важных анатомических структур человеческого организма, состояние пациента существенно ухудшается – неминуемо приближение смерти.
Структура ВИЧ
Строение нуклеокапсида ВИЧ
ВИЧ состоит из пары одноцепочечных вирусных РНК и тройки ферментов, в числе которых: ревертаза, интеграза и протеаза. Они соединены капсидными белками. На поверхности капсида расположены молекулы матриксного белка p17. Связь с геномной РНК формируется за счет нуклеокапсидного белка p7 и p9. Белок Vhr – содержимое капсида вириона.
Пояснение к обозначениям
Ревертаза – ферментный элемент, обеспечивающий синтез ДНК на матрице РНК. Обычно описываемые процессы характеризуются обратным порядком – отсюда и название фермента.
Интеграза – ферментный элемент, стимулирующий процесс интеграции вирусной ДНК в хозяйскую хромосому и стимулирующий выработку антител.
Протеаза – ферментный элемент, занимающийся расщеплением пептидных связующих звеньев между белковыми элементами, аминокислотами.
Структура оболочки ВИЧ
Оболочки клетки ВИЧ не только выполняют защитную функцию, но и помогают ей в процессе взаимодействия с клетками пораженного организма. Мембрана формируется при отпочковании и собирается из совокупности фосфолипидов с гликопротеинами и мембранных клеток. За счет гликопротеинов на поверхности клеток вирусные частицы стремятся лишь к определенным «мишеням», а именно, клеткам, содержащим рецепторы CD4 + .
Белки ВИЧ

Когда вирион нуклеокапсид оказывается внутри хозяйской клетки (теперь его именуют вирусом), под действием фермента ревертаза наблюдается синтез ДНК на матрице РНК – получается провирус.
На следующем этапе на матрицах провирусов наблюдается синтезирование новых молекул РНК вируса и структурных, регуляторных белков, ответственных за сборку и процесс отпочкования вирусов. В капсиде располагаются белки, которые вирусная частица захватывает из пораженной клетки.
Структурные белки ВИЧ
Ген Gаg ответственен за процесс синтезирования структурных белков. Речь идет об элементах, которые, в отличие от gp4 и gp120, являются составляющими капсида и мембраны.
Капсидные белки ВИЧ
Капсидные белки – единица геномных белковых соединений, формирующая ферментные элементы. Белок p24 образует мембрану нуклеокапсида, p17 – матриксное вещество, а p7, p9 собирают связь с геномной РНК.
Далее речь пойдет о белках, ответственных за ориентировку для ВИЧ-агентов на определенные клетки-мишени в организме хозяина.
Суперкапсидные белки
Env – ген, занимающийся синтезом оболочечных белков. Процесс осуществляется в рибосомах эндоплазматической сети. Эта группа элементов входит в состав наружной оболочки вириона. Речь идет о тех самых gp4 и gp120. Первый из них помогает вирионам проникнуть в клетку, а второй – обеспечивает контакт с «мишенью».
Геном Gag «на страже» выработки структурных белков. Что же собой представляют неструктурные белки?
Неструктурные белки
Речь идет об обратной транскриптазе, интегразе, протеазе, кодируемых геном Pol. Как уже упоминалось ранее, эти белки ответственны за интеграцию и размножение вируса.
Остальные гены ВИЧ
Гены Tat, Nef, Vif и Rev занимаются кодировкой белков, контролирующих процесс размножения и сборки вирусов.
Какие клетки поражаются вирусом?
Какие клетки, в первую очередь, поражает СПИД? Как только вирусные частицы оказываются в кровотоке человека, организм запускает процесс борьбы с патогенным объектом. Это происходит в результате взаимодействия антигена с особыми иммунокомпетентными клетками с клеточным рецептором CD4.
Строение возбудителя обеспечивает повреждающее действие на иммунные клетки. Белок Rev занят поражением ДНК человеческих клеток. Со стороны иммунитета хозяина в борьбу с ним вступает белок CD317, который несколько притормаживает процесс распространения антигена. При снижении количества этого белка, происходит неизбежное прогрессирование заболевания.
Т-хелперы основная мишень ВИЧ
Если обобщить, то можно утверждать, что вирус СПИДа «настроен» на поражение в крови только специфических клеток-макромеров, которые способны к связи с антигенами. Основная доля поражения приходится на лейкоциты: В-лимфоциты и Т-лимфоциты – хелперы и киллеры. Все эти представители имеют на своей поверхности особые клетки-мишени для ВИЧ. Соответственно, диагностирование недуга осуществляется, исходя из концентрации клеток CD4 – чем более развит процесс, тем она ниже.
Снижение количества Т-хелперов
При попадании вирусных частиц в организм хозяина именно Т-хелперы становятся «домом» для провокаторов и выступают в роли распространителей вируса. Взаимодействие с ВИЧ приводит к гибели Т-лимфоцитов и их распаду на отдельные фрагменты. Постепенно уровень Т4-лимфоцитов снижается – организм хозяина утрачивает иммунную функцию. Когда количество этих клеток в сыворотке крови приближается к отметке 200 в 1 мл, заходит речь о развитии СПИДа.
Изменения качества Т-хелперов
Проникновение вируса в Т-хелперы приводит не только к их гибели, но и стимулирует развитие качественных дефектов. Частые взаимодействия с провокатором становятся следствием развития неспособности Т-лимфоцитов распознавать антигены – противостоять развитию сторонних недугов.
Репликация ВИЧ

1. Встреча с клеткой
Первоначальный контакт вируса происходит посредством попадания в организм хозяина зараженного биологического материала. Вирионы концентрируются во всех биологических жидкостях. Однако наиболее опасными в отношении вероятности передачи инфекции являются: кровь, сперма, влагалищный секрет. Эти материалы содержат в себе достаточное для заражения количество вирусных частиц. Итак, жидкость оказалась в организме человека, наблюдается контакт вируса с «мишенями», другие клетки (не содержащие CD4) для провокатора на данном этапе интереса не представляют.
1. Слияние с поражаемой клеткой
Процесс слияния вируса с иммунными клетками осуществляется за счет находящихся на поверхности рецепторов CD4. Провокатор контактирует с мембраной, затем оказывается внутри клетки.
2. Обратная транскриптаза
Внутри клетки вирусное РНК выходит из капсида. Посредством обратной транскриптазы на клеточном уровне осуществляется синтез ДНК, основанный на одноцепочечной РНК. Описываемый процесс вызывает последующую интеграцию ДНК.
3. Соединение ДНК с клеточным геномом
Синтезированная ДНК, которая поражает клетку-мишень, оказывается внутри клеточного ядра. Затем наблюдается процесс ее встраивания в хромосому, который завершается образованием провируса.
4. Синтезирование белковых элементов
На этом этапе происходит синтез новых РНК на матрице провирусов с участием специальных ферментов. Кроме этого, синтезируются структурные и регуляторные белки, ответственные за сборку и увеличение количества поражающих клеток.
5. Сборка и размножение
Репликация вирусов продолжается. Вирионы, находящиеся в цитоплазме, сразу не считаются инфекционными, поскольку состоят из белков-предшественников. С развитием заболевания эти компоненты расщепляются на функциональные единицы. Когда вирион созревает, происходит его отпочкование и захват белков из оболочки клетки хозяина. Это необходимо вириону, чтобы сформировать свою мембрану.
6. Жизнь вириона после отпочкования
Продолжительность жизни вириона в плазме крови – не более 8 часов. Около половины клеток гибнет по истечении 6-ти часов. Если вирион обитает в другом биологическом материале, скажем, слюне, его жизнь существенно сокращается. На выходе из клетки вирионы продолжают инфицировать CD4-лимфоциты, эпителиальные клетки и пр.

Симптомы
До появления первых симптомов ВИЧ может пройти от 3 до 12 недель – этот период называют инкубационным. На втором этапе у большинства зараженных проявляются следующие признаки заболевания:
- Типичные симптомы на проникновение вируса. Повышение температуры тела, увеличение лимфатических узлов, общее недомогание (симптоматика схожа с проявлениями типичной простуды).
- Симптомы со стороны ЛОР-органов. Болезненность в горле, усиливающаяся в момент трапезы, разговора. Человек страдает от лихорадки, слабости.
Косвенными симптомами недуга являются:
- гипертрофия печени;
- увеличение селезенки;
- продолжительная диарея;
- высыпания на коже.
В дальнейшем у человека диагностируются вирусные, грибковые, инфекционные заболевания, поражающие слизистые оболочки и кожный покров больного.
Третья стадия ВИЧ – латентная. Выраженность симптоматики снижается, больной чувствует себя хорошо. Наблюдается лишь подверженность человека к различным инфекциям, поскольку иммунитет зараженного постепенно «сдает позиции».
На четвертой стадии патологии наблюдаются следующие симптомы:
- потеря массы тела;
- поражения внутренних органов;
- онкология;
- вирусные, бактериальные недуги слизистых оболочек и кожи.
Выше, собственно, и перечислены симптомы СПИДа. На этом этапе наблюдается истощение организма, развитие осложнений при следующих патологических процессах:
- пневмонии;
- герпеса (с поражением нервной системы и внутренних органов);
- молочницы (нередко сочетается с респираторными недугами);
- токсоплазмоза;
- туберкулеза и пр.
Помимо этого, в процессе развития ВИЧ диагностируются злокачественные опухоли и патологические процессы.
Основной удар по иммунной системе
Как уже упоминалось ранее, развитие патологии сопровождается постепенным угнетением иммунитета человека. Поражение иммунных клеток приводит к невозможности организма больного противостоять вирусу. Какими бы ни были причины развития СПИДа, по истечении нескольких лет пациент в полной мере ощущает, как именно проявляется СПИД, в то время как внутри человеческого организма продолжается процесс взаимодействия вируса со структурными элементами – прочими клетками организма (не Т-лимфоцитами).
Взаимодействие ВИЧ с моноцитами
Речь идет о самых активных фагоцитах периферической крови. При стремительном развитии заболевания они инфицируются и погибают. Эти элементы, как и Т-лимфоциты, играют роль резервуара для вируса и, несмотря на факт сохранения антимикробной функции, когда поражаются, утрачивают способность к противостоянию инфекции.
Взаимодействие вируса с макрофагами
ВИЧ поражает также макрофаги. Лимфоциты и макрофаги имеют на своей поверхности CD4-рецепторы, однако, у вторых представителей их количество снижено. Именно по этой причине эти элементы погибают не так быстро, как Т-киллеры. Вирус характеризуется тропностью к внутриэпидермальным макрофагам – клеткам Лангерганса, заполняющим ростковый слой эпидермиса. Эти структурные элементы ответственны за доставку антигенов в лимфоидную ткань, что обеспечивает активацию клеточного и гуморального иммунитета. Если клетки инфицированы, они вырабатывают цитокины, высокое содержание которых приводит к гибели клеток.
Гибель CD-4 клеток
Факторов, которые являются причиной гибели этих клеток, несколько. Основные из них: апоптоз и гиперактивация иммунитета в ответ на внедрение вируса в организм. Наибольший урон приносит уничтожение Т-лимфоцитов, дендритных клеток, памяти.
Взаимодействие вируса с дендритными клетками
Дендритные клетки отвечают за выработку гуморального и клеточного иммунитета. В большинстве своем они концентрируются в лимфоидной ткани. Они же поглощают различные антигены и передают сигнал Т-лимфоцитам. Соответственно, при их поражении прекращается процесс регулировки иммунного ответа организма – развивается неустойчивость последнего к раздражителям извне.
Патогенез повреждения мозга при недуге
Вирус склонен приводить к гибели не только иммунные клетки, но и поражать ЦНС инфицированного человека.
Каждая сотая нейроглиальная клетка разрушается за счет вызванной репликации вируса. Процесс гибели последних провоцирует трофические и функциональные повреждения в мозговой ткани и нейронах. Эти клетки приводит в никчемное состояние синдром приобретенного иммунодефицита. Развивающийся в организме больного неопластический процесс и оппортунистическая инфекция также приводят к дегенерации локальной ткани.
Патогенез поражения лимфоидной ткани при ВИЧ
Вирусная репликация наиболее оперативно протекает в лимфоидных органах. В первую очередь, речь идет о тимусе и костном мозге. Завершение процесса разрушения локальной ткани приводит к концентрации коллагена – формируется фиброзная ткань в лимфатических узлах и прочих анатомических структурах. Описанное явление становится причиной значительного сокращения количества стромальных и дендритных клеток, предотвращающих развитие апоптоза.
Поражение ЦНС (Центральной нервной системы)
В большинстве случаев при развитии ВИЧ диагностируется поражение ЦНС. Первые симптомы такого явления могут дать о себе знать как в начальный период болезни, так и при вторичных проявлениях заболевания. В некоторых случаях симптоматика поражений клеток мозга выступает единственным признаком развития СПИДа.
В начальной стадии развития инфекции (в течение 6-12 месяцев) о локальных поражениях свидетельствует прогрессирование следующих патологических процессов в организме зараженного:
- менингоэнцефалита;
- нейропатии;
- синдрома Гийена-Барре;
- миелопатии.
При отсутствии соответствующих терапевтических мероприятий следует проявление следующих патологий:
- лимфомы;
- саркома Капоши;
- инфаркта мозга;
- абсцесса и др.
Внимание! Поскольку в большинстве своем в процессе развития патологии происходит поражение мозга, что приводит к нарушению в ЦНС, очень важно своевременно начать терапию, дабы исключить появление осложнений.
Поражение других органов и систем
В случае с ВИЧ заходит речь и о поражении других внутренних органов, в частности, системы дыхания. Явление выражается в развитии бронхиальной астмы, пневмонии, туберкулеза и других патологий.
В числе ключевых признаков локальных патологических процессов:
- повышение температуры тела;
- выделение мокроты при кашле.
Больные, обозначившие такие признаки, могут продолжать лечиться от предполагаемых заболеваний дыхательной системы. Однако непродолжительное затухание симптоматики вновь сменяется прогрессированием патологического процесса.
При подобных обстоятельствах у инфицированных лиц очень часто появляется туберкулез, так как ослабленный иммунитет не может справиться с инфекцией. У этих пациентов недуг быстро набирает темпы развития, протекает ярко, практически не поддается лечению и быстро приводит к смерти больного.
Множественные дефекты внутренних органов (ткани кишечника, пищеварительной, сердечно сосудистой системы и пр.) приводят к присоединению оппортунистских инфекционных процессов, которые крайне опасны для инфицированного человека.
Профилактические меры
Лечение
На сегодняшний день больных СПИДом вылечить невозможно. Однако существуют медикаменты, которые способны продлить жизнь инфицированному. При использовании подобных препаратов CD4-лимфоциты приумножаются, иммунная система человека получает существенную поддержку.
Лечение по мере протекания ВИЧ рознится. Так, при первой стадии терапия не назначается, хоть антитела к ВИЧ в организме больного уже вырабатываются. На втором этапе (стадия 2А) к лечению также не прибегают, за исключением ситуаций с уровнем лимфоцитов меньше 200 на мм 3 . С дальнейшей сменой стадии болезни меняется и тактика терапии недуга. В период развития СПИДа терапевтический курс назначается больному пожизненно.
Однако недавние исследования доказали, что раннее введение терапии приносит гораздо более позитивные результаты. Поэтому с большой долей вероятности представленные рекомендации в скором времени будут скорректированы.
Распространенность СПИДа в мире на 2009 год.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: СПИД это болезнь иммунной системы, вызываемая вирусом иммунодефицита человека (ВИЧ). При СПИДе у человека медленно, но верно (в течение нескольких лет) развивается тотальный иммунодефицит, когда организм не может справиться почти ни с какими микробами (даже теми, которые никогда не заражают здорового человека). Так как иммунитет борется не только с микробами, но и с раковыми клетками, еще у заболевшего СПИДом резко повышается вероятность заработать рак. ВИЧ использует изощренные механизмы обхода и уничтожения нашей иммунной системы, всегда идя на шаг впереди нее.

Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система
Для того чтобы разобраться, как вирус иммунодефицита человека (а именно так расшифровывается ВИЧ) разрушает иммунную систему, нужно прежде всего понять, что же это такое — иммунная система. Согласно одному из определений (по Р.В. Петрову), иммунитет — это способ защиты организма от живых тел и веществ, несущих в себе признаки генетической чужеродности. Проще говоря, иммунитет — это то, что защищает нас от бактерий, вирусов, любых высокомолекулярных чужеродных веществ (вспомним иммунитет против змеиного яда), попавших в организм, а также раковых клеток. В его основе лежат фагоциты (у животных называемые макрофагами), собственно уничтожающие (поглощающие) чужеродные тела, а также Т- и В-клетки иммунитета, осуществляющие точное «наведение» фагоцитов на патоген. При проникновении микроба в организм фагоциты его поглощают и переваривают [29].
Первичное распознавание врага происходит при помощи Toll-like рецепторов, или TLR [30]. Эти молекулы распознают структуры, общие для многих классов патогенов, но отсутствующие у человека (к примеру, TLR5 распознает белок флагеллин — главный компонент жгутиков бактерий, — а TLR3 активируется при наличии двухцепочечной РНК, появляющейся в жизненном цикле многих вирусов, в частности вируса гриппа А). После поглощения микроба его остатки «показываются» (презентируются) Т-хелперам. Т-хелперы активируются, и в свою очередь помогают активироваться B-лимфоцитам (последним для активации нужны молекулы патогена и сигналы активации от Т-хелпера). После этого B-лимфоциты превращаются в плазматические клетки и начинают синтез антител — молекул иммунитета, маркирующих вещества, подобные тем, что активировали B-лимфоциты. Антитела циркулируют в кровотоке и маркируют структуры патогена. Маркированные микробы и другие чужеродные тела поглощаются фагоцитами более эффективно.
Такой «сценарий» работает, когда микроб находится вне клеток организма (в случае заражения большинством бактерий и грибов). Если же враг проникает внутрь клетки (вирусы, некоторые бактерии, простейшие), а также когда враждебной становится сама клетка организма (в случае рака), в дело вступают Т-киллеры. Они находят и уничтожают зараженные клетки, после чего остатки этих клеток поглощаются все теми же фагоцитами. Для активации Т-киллерам требуются Т-хелперы. Помимо Т-киллеров в этом «сценарии» участвуют антитела (и, соответственно, B-лимфоциты), но их роль меньше, чем T-киллеров. Разумеется, в иммунитете есть и другие участники, но основной акцент в борьбе с ВИЧ приходится на тех, что были названы выше.

Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
рисунок автора статьи
Жизненный цикл ВИЧ
Рассмотрим жизненный цикл ВИЧ (см. видео). Первая стадия — это проникновение вируса. Сначала любой вирус должен как-нибудь «зацепиться» за клетку, и у разных вирусов для этой цели есть разные «якоря». Имеется таковой и у ВИЧ — белок gp120, который способен взаимодействовать с белком СD4 поверхности человеческой клетки. Это рецептор, присутствующий на многих клетках организма, но больше всего его на Т-хелперах (другое их название — СD4 + T-лимфоциты), — именно на них и направлен ВИЧ в первую очередь. При первоначальном связывании gp120 с CD4 вирусный белок изменяет свою форму и связывается с другими белками поверхности клетки — СХСR4 и ССR5, после чего происходит погружение другого вирусного белка — gp41 — в мембрану клетки. Вслед за этим оболочки клетки и вируса сливаются, и наследственный материал вируса попадает в цитоплазму клетки.
Видео. Жизненный цикл ВИЧ.
Нормальная функция СХСR4 и ССR5 — рецепция цитокинов (небольших растворимых молекул иммунной системы, посредством которых клетки иммунитета «общаются» друг с другом и другими клетками организма). Именно с мутацией ССR5 (Δ32 CCR5) связана врожденная устойчивость некоторых людей, гомозиготных (имеющих 2 копии мутированного CCR5) по этому гену, к ВИЧ [12], [18] (таких людей до 2% в Европе, Индии и странах Ближнего Востока [13]). К сожалению, эта устойчивость не является полной [3]; есть штаммы, заражающие и таких людей. Зато она в какой-то степени проявляется даже у гетерозигот (имеющих одну копию мутированного и одну копию обычного ССR5 ) [12], [18].

Рисунок 2. Проникновение вируса в клетку. А — первоначальное «зацепление» вируса с клеткой; В — начальный этап слияния вируса с клеткой. Условные обозначения: HIV-1 — поверхность капсида наиболее распространенной разновидности вируса — ВИЧ-1; Т-cell — поверхность Т-хелпера; gp120 — вирусный рецептор к к человеческому белку CD4; CD4 —корецептор во взаимодействии Т-лимфоцитов и антиген-презентирующих клеток; одновременно является рецептором к gp120; gp41 — вирусный белок, за который закреплен gp120; помимо этого играет важную роль в слиянии мембран вируса и клетки; CXCR4 или ССR5 — рецепторы хемокинов; корецепторы для белка gp120; RNA — вирусный геном.
После проникновения наследственного материала ВИЧ в клетку происходит процесс обратной транскрипции, то есть перенос информации с вирусной РНК на ДНК. Происходит это потому, что вирусный геном записан в виде РНК, а геном человека — в виде ДНК. Вирусу же «хочется» записать себя в геном клетки, ведь именно он управляет последней. К тому же, если иммунитет имеет средства для распознавания вирусных белков и РНК, то ДНК, интегрированную в геном клетки, иммунитет распознать не может.
Обратная транскрипция осуществляется вирусным белком обратной транскриптазой [31]. Обратная она потому, что обычно в клетке все наоборот — информация переносится с ДНК на РНК (а с РНК — в последовательность аминокислот белков). РНК по сравнению с ДНК очень нестабильна, и поэтому для ВИЧ характерна огромная скорость мутации — в десятки тысяч раз быстрее, чем для человека. Если скорость нейтральных мутаций для ДНК составляет у различных видов и для различных генов в среднем меньше 10 −9 замен на сайт в год, то скорость мутирования генетического материала РНК-вирусов — около 10 −3 замен на сайт в год (у гена env ВИЧ: 10 −2 –10 −3 замен на сайт в год [21]). Это одна из причин, почему иммунная система не может справиться с ВИЧ — он слишком быстро изменяется.
После обратной транскрипции геном вируса вставляется в геном человека вирусным белком интегразой. Проникнув в геном, вирус может «сидеть» в нем несколько лет, никак себя не проявляя. В основном, вирус начинает размножаться в активированных (делящихся) T-лимфоцитах, хотя по немногу он может работать и в неделящейся клетке [17]. Это главная причина, почему ВИЧ неизлечим (но есть работа, в которой полностью удалось излечить от ВИЧ клеточную культуру [32]) — в человеке всегда есть «дремлющие» копии вируса, неопределимые для иммунной системы, но способные к «пробуждению» в любой момент (та же история и с герпесом — его как и ВИЧ невозможно полностью удалить из организма).
«Будильником» для вируса служит активация клетки: промотор вируса содержит последовательность, гомологичную последовательности NF-κB [10], [15], каковая есть у многих генов иммунитета. (Промотор регулирует работу гена и определяет, как, когда и в каких количествах будет появляться белок в той или иной клетке.) Вспоминая о том, что ВИЧ заражает в основном Т-хелперы, мы получаем интересную картину: пока клетка не активирована, вирус «спит»; как только клетка начинает выполнять свою функцию (иммунитет) — вирус «просыпается» и убивает эту клетку. Можно также добавить, что при ВИЧ-инфекции активируются в первую очередь те клоны Т-клеток, которые специфичны для ВИЧ-белков.
Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
Перейдем теперь к тому, как вирус уничтожает иммунную систему. В основном все сводится к включению у Т-клеток запрограммированной клеточной гибели, или апоптоза (В норме апоптоз включается у клеток, которые дефектны или не нужны организму — например, у клеток хвоста эмбриона человека. Большинство потенциальных раковых клеток умирает путем апоптоза. Более того, если клетка «почувствует» при помощи TLR’ов заражение вирусом, она попытается умереть опять-таки через апоптоз (хотя почти у всех вирусов есть механизмы его блокирования)). Само производство вируса не проходит для Т-хелпера бесследно, и со временем он погибает. Причины этого до конца не понятны, но можно выделить несколько возможных.
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4 + -клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
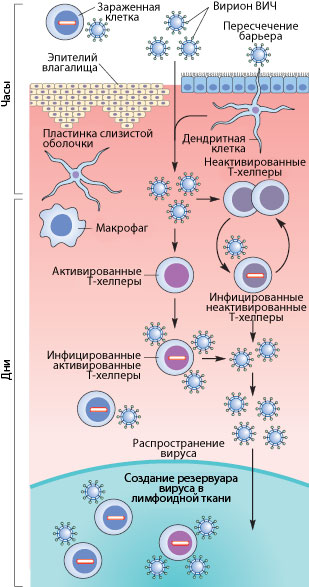
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Но даже в отсутствии микротравм ВИЧ может проникнуть внутрь организма через дендритные клетки (разновидности макрофагов), которые могут выпускать свои отростки в просвет слизистой. Там они захватывают вирусы и бактерии, после чего происходит презентация захваченного материала Т-хелперам. Таким образом организм готовится «тепло встретить» микробов, присутствующих в окружающей среде. Но в нашем случае, дендритные клетки лишь заражаются вирусом — напрямую свободными вирионами или же при контакте с зараженными лимфоцитами, которые могут присутствовать в сперме (общее число лимфоцитов в сперме — до 1 млн/мл и больше).
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
О том, как вести себя, чтобы не заразиться ВИЧ, и что делать, если это все-таки произошло, читайте в статье «Связанные одной лентой» [33]. — Ред.
Заключение
На данный момент имеется огромное количество информации о ВИЧ; известны его структура, последовательность генома, жизненный цикл; изучен почти каждый шаг вируса в организме. Уже сейчас на стадии клинических испытаний находится множество лекарственных средств, а ВААРТ (высокоактивная антиретровирусная терапия) позволяет зараженному ВИЧ иметь почти такую же продолжительность жизни, как у здорового человека. Науке известно и два случая полного излечения от ВИЧ. Один из них известен как случай «берлинского пациента», которому пересадили костный мозг от донора с мутацией Δ32 ССR5. Другой прецедент произошел в США, где ребенка, родившегося от ВИЧ-инфицированной матери, сразу после рождения подвергли ВААРТ. Через два года после рождения девочки мать отказалась продолжать ее лечение, и через 10 месяцев при повторном осмотре врачи констатировали полное выздоровление девочки.
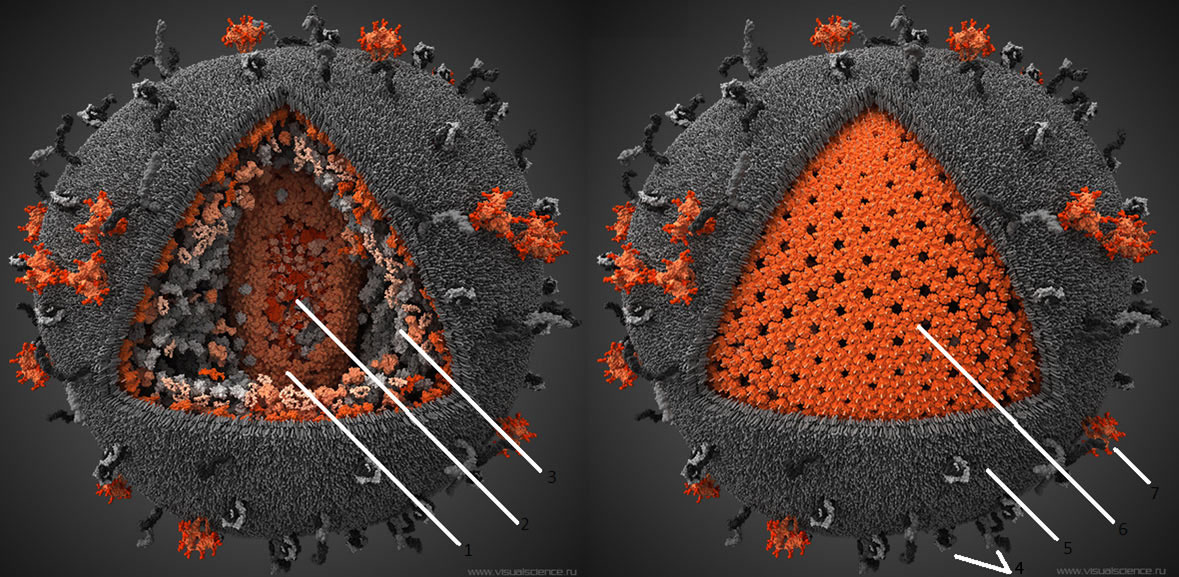
Рисунок 4. Компьютерная модель ВИЧ. Серым цветом показаны человеческие структуры, «украденные вирусом из клетки», красным — вирус-специфические белки. 1 — капсид вируса, состоит из 250 гексамеров и 12 пентамеров белка p24. 2 — Геном вируса, а также связанные с ним белки, представлен двумя идентичными молекулами РНК по
10000 нуклеотидов в каждой. Всего геном включает девять генов, которые в результате альтернативного сплайсинга кодируют 15 различных белков. 3 — Различные белки, захваченные вирусом из хозяйской клетки. 4 — Человеческие белки, обычно находящиеся на поверхности мембраны клеток. Захваченые в результате отпочковывания, они увеличивают вирулентность вируса. 5 — Внешняя оболочка ВИЧ, ведущая свое происхождение от цитоплазматической мембраны клетки, от которой когда-то отпочковался вирион. 6 — Матрикс, образованный тримерами белка р17. 7 — Тримерные комплексы белков gp120 и gp41, при помощи которых вирус проникает в клетку. На поверхности среднего вириона насчитывается около 20 таких тримеров. Чтобы увидеть рисунок в полном размере, нажмите на него.
. Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.
6.3. ПАТОГЕНЕЗ ВИЧ-ИНФЕКЦИИ
В связи с тем что вирусы являются патогенами внутриклеточными, ка-ждый представитель мира вирусов имеет тропность к определенному типу клеток. Тропизм вируса определяется наличием на клетке-мишени рецептора для данного вируса, а также возможностью генома вируса встроиться в геном клетки. Рецепторы для определенного вируса могут быть на клетках различ-ных типов. Рецепторную функцию выполняют различные структуры (лиган-ды): белки, липиды, углеводные компоненты белков и липидов. Эти лиганды локализованы на плазматической мембране и выполняют важнейшие функ-ции жизнеобеспечения клетки – проникновение в нее гормонов, питательных веществ, факторов роста и регуляции и т.п.
Рецепторы, независимо от их биохимического строения, имеют общую структурную характеристику, а именно, состоят из участка, расположенного вне клетки, участка, локализованного внутримембранно, и участка, погру-женного в цитоплазму.
Рецепторами для ВИЧ являются дифференцировочный антиген CD4, а также неспецифические, не зависящие от наличия CD4 компоненты. CD4 -гликопротеид с молекулярной массой 55 000, по своему строению имеющий гомологии с определенными участками иммуноглобулинов. Аналогичные гомологии имеет и белок вируса gp120, что и определяет тропность ВИЧ. Фиксация вируса через gp120 ВИЧ-1 (или gp105 в случае инфицирования ВИЧ-2) с мембранным рецептором CD4 клетки хозяина блокирует основную функцию этих иммунокомпетентных клеток — восприятие сигналов от анти-генпрезентирующих клеток. Последующая за рецепцией репликация вируса ведет к гибели клеток, выпадению функции, ими выполняемой, развитию иммунодефицита.
В организме человека имеется целый ряд иммунокомпетентных, сома-тических и ряд других клеток, имеющих рецепторы для ВИЧ (CD4+ лимфо-циты, CD8+ лимфоциты, дендритные клетки, моноциты, эозинофилы, мега-кариоциты, нейроны, микроглия, сперматозоиды), и наблюдается цитопати-ческий эффект во многих из них в случае проникновения вируса.
Помимо основного рецептора для ВИЧ-1 – CD4, имеется еще ряд коре-цепторов, в частности, хемокиновые рецепторы, необходимые для проникно-вения ВИЧ в клетку. Хемокины – полипептиды, вызывающие движение кле-ток в определенной направленности. У человека выделено около 40 отдель-ных подобных белков, их подразделили на альфа- и бета-хемокины. В лабо-ратории Р.Галло в 1995 году были выделены хемокины из CD8-лимфоцитов и два белка из макрофагов. Эти три хемокина блокируют инфицирование CD+ мононуклеаров макрофаготропными, но не лимфотропными вариантами ВИЧ-1.
В 1996 году Бергер открыл корецептор для ВИЧ. Этот рецептор вместе с CD4 опосредует инфицирование СО-вариантами ВИЧ-1, адаптированных к росту в Т-хелперах, но не в макрофагах. На сегодня известно около 10 хемо-киновых рецепторов.
Таким образом, выделены белки — хемокины, блокирующие проникно-вение ВИЧ в макрофаги с антигеном CD4, и белки — корецепторы, способст-вующие инфицированию. При этом корецепторы – это рецепторы для хемо-кинов, но их использует ВИЧ в качестве рецептора, с помощью которого проникает внутрь клетки.
Проникнув в СD4+ клетки, ВИЧ сразу же начинает репликацию, при этом, чем активнее CD4+ клетки, тем выше процесс репродукции вируса. Все регуляторы, активирующие СD4+клетки, обеспечивают увеличение реплика-ции вируса. К подобным регуляторам относятся фактор некроза опухолей (ФНО), фактор, стимулирующий колонии гранулоцитов/макрофагов, интер-лейкин-6 (ИЛ-6). К негативным регуляторам, тормозящим репликацию виру-са, относятся интерферон (ИФ) и трансформирующий фактор роста.
Морфофункциональные изменения в моноцитах/макрофагах оказыва-ют разнонаправленное действие не только на Т-лимфоциты, но и естествен-ные киллеры — главные клетки противоопухолевой защиты. Активность по-следних по мере прогрессирования заболевания неуклонно снижается. Дефи-цит ИЛ-2 и γ-интерферона даже при нормальном количестве NK-клеток ве-дет к снижению функциональной активности их у больных ВИЧ-инфекцией (Ковальчук Л.В., Чередеев А.Н.,1991).
Выделено два типа CD4+клеток: Т-хелперы-1 (Th1) и Т-хелперы-2 (Th2). Тh1 продуцируют цитокины, стимулирующие клеточный иммунитет, а Тh2 – цитокины, усиливающие антителогенез. Соотношение Тh1 и Тh2 взве-шенно и конкурентно; суперэкспрессия цитокинов одного типа клеток ведет к супрессии другого. У больных ВИЧ-инфекцией идет угнетение Тh1, чем обеспечиваются и вирусная патология, и онкогенез.
Жизненный цикл ВИЧ после проникновения в организм имеет после-довательный характер: связывание вириона с поверхностью клетки, слияние мембран вириона и клетки, проникновение вируса внутрь клетки, высвобож-дение нуклеотида и геномной РНК вируса, интеграция генома вируса в геном инфицированной клетки, латентная фаза, фаза активации транскрипции с ДНК провируса и последующая транскрипция белков вируса, наработка всех компонентов вируса с формированием новых вирионов и их высвобождени-ем из клетки, влекущим за собой гибель клетки-мишени (рис.6.4.).

Рис. 6.4. Стадии проникновения ВИЧ в клетку (Ледванов М.Ю., 1997).
Судьба ДНК-транскрипта генома ВИЧ, интегрированных в хромосому пораженной клетки, может быть различна. Она определяется активностью положительных и отрицательных регуляторных генов. Если активны все по-ложительные регуляторные гены, то происходит репродукция вируса со все-ми вытекающими отсюда последствиями – идет активация инфекции.
Если активны все отрицательные регуляторные гены, синтеза компо-нентов вириона не происходит, и инфекция не развивается.
Если активны положительные регуляторные гены белков суперкапсид-ной оболочки, происходит образование этих белков, и они экспрессируются на поверхности инфицированных клеток. Такие клетки способны взаимодей-ствовать с CD4 — рецепторами клеток организма и нарушать их функции. Та-ким образом, хотя репродукции вирусов не происходит, имеют место опре-деленные проявления инфекции.
Равным образом события развиваются при активности положительных регуляторных белков капсидной оболочки. Их повреждающее действие на клетки существенно ниже, но они индуцируют образование соответствую-щих антител.
Если же активны положительные регуляторные гены только геномных белков, то в пораженных клетках образуется обратная транскриптаза, которая довольно быстро разрушается.
Сродство вирусного мембранного гликопротеида gp120 (gp105 в случае ВИЧ-2) к клеточному рецептору CD4 определяет высокую степень избира-тельного поражения клеточных структур, поэтому в патологический процесс вовлекаются, в первую очередь, и в большей степени CD4+ лимфоциты, мо-ноциты крови, макрофаги тканей, дендритные клетки крови, лимфатических узлов, селезенки, кожи, альвеолярных и интерстициальных макрофагов лег-ких, микроглия и другие клетки нервной системы, имеющие CD4 — рецепто-ры. Так же поражаются В- и О-лимфоциты, ретикулярные клетки, эпители-альные клетки кишечника, клетки Лангерганса, причем последние инфици-руются даже легче, чем CD4+ лимфоциты. Именно клеткам Лангерганса придается большое значение в распространении ВИЧ по организму, ибо в них вирус сохраняется длительное время, иногда годы.
Наличие CD4 рецептора на многих и не только иммунокомпетентных клетках, возможность поражать и клетки, не имеющие этого рецептора, оп-ределяют политропность ВИЧ и полиморфизм клинической картины. Сте-пень поражения тех или иных, содержащих СD4 рецепторы, клеток зависит от плотности этих рецепторов на мембране клеток. Наиболее высока плот-ность на Т-хелперной субпопуляции лимфоцитов, что и определяет во мно-гом патогенез болезни. Но степень поражения клеток-мишеней вирусом за-висит также и от возможности репликации вируса в том или ином виде кле-ток. Очевидно, осуществляется репликация в основном в лимфоцитах с CD4+ фенотипом и моноцитах/макрофагах.
Если на CD4+ лимфоциты вирус оказывает цитопатическое действие с лизисом клетки или слиянием в синцитий, то в моноцитах/макрофагах ВИЧ реплицируется с умеренной интенсивностью; вирионы оформляются в ок-руглые частицы еще в цитоплазме клетки и по выходе из нее не оказывают цитонекротического действия. Изучение динамики сывороточных монокинов подтверждает активное участие в патогенезе ВИЧ-инфекции моноци-тов/макрофагов, основных продуцентов фактора некроза опухолей и интер-лейкина-1b (выполняющих роль передатчика Т-лимфоцитам антигенспеци-фических сигналов, необходимых для их активации в иммунном ответе). С гиперпродукцией ФНО-a , ИЛ-1b и ИЛ-6 связывают развитие при ВИЧ-инфекции лихорадки, анемии, диареи, кахексии, патологических изменений на коже и слизистых при саркоме Капоши, церебральных симптомов. ФНО-a при этом оказывает прямое цитопатическое действие на инфицированные ВИЧ Т-хелперы. В то же время было установлено, что ВИЧ ингибирует про-дукцию ИЛ-2 и γ-ИФ, синтезируемым Т-хелперами первого типа, и не инги-бирует функцию Т-хелперов второго типа. Следовательно, играя важную роль в регуляции синтеза цитокинов, ВИЧ за счет переключения иммунного ответа с Т-хелперов первого типа на Т-хелперы второго типа, стимулирует гуморальное звено иммунитета.
После инфицирования клетки вирусом происходит соединение вирус-ной оболочки с помощью белка gp41 с мембраной клетки. Помимо того, ви-русный белок gp41 обеспечивает слияние мембран соседних клеток между собой с образованием одной многоядерной клетки — синцития. При этом слияние может быть как зараженных клеток между собой, так и зараженных с незараженными. Но синцитий в основном индуцируют вирусы, выделенные от больных с клиническими проявлениям ВИЧ-инфек-ции, и не образуют выделенные от инфицированных людей, не имеющих клинических проявле-ний.
С момента интеграции генома вируса в геном клетки начинается стадия латентной инфекции. В этот период вирус находится в клетке в виде интег-рированного в геном ДНК – провируса. Раньше полагали, что в этот период отсутствуют процессы транскрипции и трансляции с вирусных генов, а по-этому и экспрессии вирусных белков, нет иммунного ответа на вирус как в виде специфических иммуноглобулинов, так и сенсибилизированных лим-фоцитов. Но последние исследования показали, что сразу после проникнове-ния вируса в клетку начинаются и трансляция, и транскрипция.
Состояние латентной инфекции без клинических признаков болезни может длиться от 2 до 11 лет. Активация длинных концевых повторов и экс-прессия генов ВИЧ, кодирующих белки вируса, знаменуют собой манифе-стацию болезни.
В расшифровке патогенеза ВИЧ-инфекции многие вопросы решены, установлены основные этапы развития процесса в клетке после инфицирова-ния ее вирусом. Выявлен ряд факторов, активирующих экспрессию генов ВИЧ. К ним относятся факторы, активирующие Т-лимфоциты: специфиче-ские антигены (например, вирусы группы Herpes), неспецифические антиге-ны (например, митогены типа фитогемаглютинина), цитокины (например, фактор некроза опухолей, некоторые интерлейкины, гамма-интерферон), бактериальные иммуномодуляторы (например, монофосфат липида из саль-монелл). К активаторам экспрессии ВИЧ относятся глюкокортикостероидные гормоны, в частности, дексаметазон и гидрокортизон, ультрафиолетовое об-лучение, перекись водорода, свободные кислородные радикалы. Активирует инфекционный процесс беременность; более прогрессирующее течение ВИЧ-инфекции имеют психически неуравновешенные лица, дезадаптированные, по сравнению с людьми, имеющими уравновешенную психику.
Довольно сложен и до конца не выяснен механизм репликации вируса в инфицированной клетке. Известно, что в цитоплазме информация с вирус-ной РНК посредством обратной транскриптазы (ревертазы) переписывается на ДНК, первоначально образуется однонитевая структура; затем та же об-ратная транскриптаза обеспечивает образование второй нити, и линейная промежуточная форма ДНК-транскриптаза вируса — транспортируется в ядро, где с помощью фермента интегразы интегрирует в хромосому клетки, пре-вращаясь в провирус.
Исключительно важный этап патогенеза болезни – сборка вирусных частиц и выход нового потомства вируса из инфицированной клетки. Сборка происходит на плазматической мембране лимфоцита, куда поступают все компоненты вирусной частицы, в том числе и белки-предшественники. За-вершается процесс почкованием вирусных частиц с клеточной поверхности. Отличительной чертой ВИЧ является взрывной характер процессов актива-ции транскрипции, синтеза белков-пред-шественников, сборки вирионов и их почкования: за 5 мин одна лимфоцитарная клетка может образовать до 5000 вирусных частиц.
Ключевой вопрос патогенеза ВИЧ-инфекции – механизм иммунного повреждения. Как установлено, в составе белков gp120, главного комплекса гистосовместимости (HLA) класса II и CD4-рецепторов имеются сходные участки, что определяет перекрестное реагирование образующихся к ВИЧ антител с этими структурами. Например, происходит блокада кооперации CD4+ лимфоцитов и HLA II. Антитела к gp120 ВИЧ реагируют с CD4, обу-словливая неадекватную стимуляцию CD4+ клеток. На всех ядросодержащих клетках имеются антигены HLA I; вирус же нарушает синтез этих антигенов, участвующих в распознавании CD8+ лимфоцитами зараженных вирусом клеток, что тормозит процесс лизиса инфицированных клеток.
Взаимосвязь жизненного цикла вируса и иммунных сдвигов в началь-ной фазе ВИЧ-инфекции изучена в эксперименте при заражении SIV обезьян; полученные данные экстраполированы на человека. Как показали исследова-ния, вирус первоначально локализуется в лимфоидной системе, вирусная экспрессия определяет клинику ранней фазы болезни. Пик экспрессии вируса в клетках лимфоидной ткани предшествует накоплению его в плазме. Появ-ление вирусспецифических цитотоксических Т-лимфоцитов (CTL) совпадает со временем окончания экспрессии вируса в лимфатических узлах. Продук-ция комплементсвязывающих антител облегчает переход вируса в сеть денд-ритных клеток герминальных центров лимфатических узлов. Повреждающее действие CTL и продукция комплементсвязывающих антител оказывают ос-новное патогенное действие в результате виремии. Образование нейтрали-зующих антител обеспечивает переход острой фазы болезни в хроническую.
Иммунопатогенетически ВИЧ-инфекция проявляется дефицитом Т- и В-звеньев иммунной системы, дефицитом комплемента, фагоцитов, сниже-нием функции неспецифических факторов защиты. В результате идет фор-мирование анергии с проявлениями аллергического, аутоаллергического и иммунокомплексного патологического процесса. Уже во II стадии ВИЧ-инфекция характеризуется снижением абсолютного числа лейкоцитов за счет CD3+, CD4+, p24+ и gp120+ лимфоцитов, повышением уровня естественных киллеров (NК-клетки), нарастанием реакции торможения миграции лимфо-цитов с конкавалином А и фитогемагглютинином. Изменения гуморального звена иммунитета проявляются нарастанием IgG+ В-лимфоцитов и 4-5-кратным ростом уровня сывороточных IgE.
Для изменений В-звена иммунитета характерна активация В-лимфоцитов. Изменение их метаболизма сопровождается уменьшением вре-мени полуобмена иммуноглобулиновых рецепторов с повышением в крови концентрации клеточных рецепторов (Р-белки). Суммарная концентрация сывороточных иммуноглобулинов растет, но выявляется диспропорция уровней подклассов иммуноглобулинов. Так, содержание IgG1 и IgG3 у больных увеличивается, а концентрация IgG2 и IgG4 существенно уменьша-ется. Очевидно, повышение уровня IgG2 связано с высокой восприимчиво-стью больных к стафилококкам, пневмококкам, палочке инфлюэнцы. Не-смотря на гипергаммаглобулинемию, увеличение количества циркулирую-щих в крови В-лимфоцитов, их функциональная активность на митогены ос-таются относительно сниженными, что позволяет В-систему иммунитета у ВИЧ-больных расценивать как супрессированную. К тому же, количество В-клеток в периферической крови больных в стадии СПИДа может быть сни-жено в три и более раз.
Многочисленными исследованиями показано, что взаимодействие gp120 ВИЧ-1 с мембраной CD4+ лимфоцитов определяет не только отрица-тельные реакции инфицированных клеток, но и приводит к программирован-ной клеточной гибели — апоптозу зрелых CD4+ лимфоцитов или CD34+ ге-мопоэтических клеток-предшественников даже при отсутствии их инфици-рования вирусом.
Специфический иммунный ответ при ВИЧ-инфекции имеет ряд осо-бенностей. Локализуясь в иммуноците, вирус проникает в органы и ткани, пребывая вне доступности для иммунной системы, чем определяется перси-стенция в клетках как вируса, так и его компонентов – белков, нуклеокапси-дов, нуклеиновой кислоты. Активация инфекционного процесса ведет к гу-моральному иммунному ответу с образованием антител. Но в связи с наличи-ем в составе вирусного белка gp120, HLA класса II и CD4-рецептора лимфо-цита сходных участков образующиеся антитела перекрестно реагируют с ни-ми, чем обусловливают нарушение кооперативных взаимодействий в функ-ционировании иммунной системы. Все это определяет формирование ауто-аллергических реакций. Именно поэтому в ходе развития инфекционного процесса формируется гиперчувствительность замедленного и немедленного типов, преимущественно к антигенам ВИЧ, в частности, gр41 и gp120. Так, Л.Монтанье (1996) считает, что в патогенезе СПИДа основное место принад-лежит аутоиммунному процессу. В пользу этого говорят исследования харак-тера иммунных реакций у больных: наличие аутоантител и аллоантител к лимфоцитам, формирование аллергических реакций цитотоксического типа, накопление циркулирующих иммунных комплексов, наличие комплементо-посредованной цитотоксичности, активация антителозависимой клеточной цитотоксичности. Кроме того, при сильном антительном ответе возможность развития аутоиммунных процессов обусловлена мимикрией структуры gp120 под структуру иммуноглобулинов (Atlan H. et al.,1993). В пользу наличия ау-тоиммунных процессов в патогенезе ВИЧ-инфекции говорят и клинические проявления болезни, в частности, часто сопутствующие болезни такие ти-пичные аутоаллергические варианты патологии, как спондилоартропатии, системные ревматоидные синдромы: волчаночноподобный синдром Шегре-на, полимиозит, некротизирующий васкулит.
У половины больных развиваются манифестные формы аллергии, пре-имущественно в виде ринита, лекарственной аллергии, крапивницы, атопиче-ского дерматита, ангионевротического отека с повышением у них уровня специфических IgE к бытовым, эпидермальным, пыльцевым и пищевым ал-лергенам с положительной коррелятивной связью между общим уровнем IgE и содержанием СD8+ лимфоцитов (Ю.А.Митин, 1997).
Формирование иммунодефицита при ВИЧ-инфекции не ограничивает-ся только поражением лимфоцитов с CD4-фенотипом. Так, нарушение синте-за белков HLA I ведет к ингибированию функции лимфоцитов с CD8-фенотипа, то есть Т-супрессоров. Белок вируса р15 оказывает супрессивное действие на продукцию Т-клетками ИЛ-2 и γ-интерферона. Известно, что для дифференцировки Т-эффекторов из Т-предшествен-ников необходимы ИЛ-2, γ-интерферон и ИЛ-6. А с продукцией ИЛ-2 и других цитокинов тесно связа-на функция цитотоксических Т-лимфоци-тов, ответственных за противови-русную и противоопухолевую защиту организма. Все это патогенетически определяет характерную для ВИЧ-инфекции ассоциированную вирусную, бактериальную, грибковую и онкопатологию.
Наряду с поражением иммунной системы в патологический процесс вовлекается и кроветворная ткань. Для заболевания характерны лейкопения, анемия, тромбоцитопения. Угнетается функциональная активность грануло-цитов. У больных ВИЧ-инфекцией в костном мозге резко снижено содержа-ние колониеобразующих единиц гранулоцитов, макрофагов, мегакариоцитов. Однако дисфункция стволовых клеток не связана с их прямым инфицирова-нием, ибо не обнаружено присутствия ВИЧ в кроветворных клетках при изу-чении методом гибридизации in situ и иммуногистохимическим исследова-нием гемопоэтических колоний, а также с помощью полимеразной цепной реакции. Пока нет однозначного мнения о причинах ингибиции пролифера-тивной активности стволовых клеток, хотя и установлено, что различные изоляты ВИЧ, воздействуя на CD34+ клетки, угнетают их функциональную активность. Также установлено, что подавление кроветворения в результате действия ВИЧ связано с усилением продукции костномозговыми моноцита-ми/макрофагами фактора некроза опухолей.
Таким образом, поражение иммунной системы при ВИЧ-инфекции но-сит системный характер, проявляясь глубокой супрессией Т- и В-звеньев клеточного иммунитета. В ходе развития ВИЧ-инфекции происходят законо-мерные изменения гиперчувствительности немедленного и замедленного ти-па, гуморального иммунитета и факторов неспецифической защиты, функ-циональной активности лимфоцитов и моноцитов/макрофагов. Нарастает уровень сывороточных иммуноглобулинов, циркулирующих иммунных ком-плексов. Наряду с дефицитом CD4+ лимфоцитов в динамике болезни нарас-тает функциональная недостаточность СD8+ лимфоцитов, NK-клеток, ней-трофилов. Нарушение иммунного статуса клинически проявляется инфекци-онным, аллергическим, аутоиммунным и лимфопролиферативным синдро-мами иммунологической недостаточности, синдромом, свойственным болез-ни иммунных комплексов. Все это определяет в целом клинику ВИЧ-инфекции.
 Российская Академия Естествознания (Международная ассоциация учёных, преподавателей и специалистов) приняла участие в 32-й Московской международной книжной выставке-ярмарке, г. Москва, ВДНХ, 4-8 сентября 2019 года.
Российская Академия Естествознания (Международная ассоциация учёных, преподавателей и специалистов) приняла участие в 32-й Московской международной книжной выставке-ярмарке, г. Москва, ВДНХ, 4-8 сентября 2019 года.



