Интраэпителиальная неоплазия высокой степени шейки матки
Содержание
- 1 Общая информация
- 2 Как устроена шейка матки
- 3 Классификация патологии
- 4 Легкая неоплазия
- 5 Дисплазия умеренной степени
- 6 Тяжелый случай
- 7 Причины возникновения
- 8 Симптоматика
- 9 Диагностирование
- 10 Способы лечения
- 11 Использование медикаментов
- 12 Хирургия
- 13 Возможные последствия
- 14 Патология и беременность
- 15 Альтернативная методика
Цервикальная интраэпителиальная неоплазия чаще всего среди специалистов в области гинекологии зовется дисплазией шейки детородного органа. Такая патология многослойного плоского эпителия расценивается как предраковое состояние, где высок риск изменения клеток. В то же время заболевание поддается лечению.
В большинстве случаев женский организм самостоятельно справляется с недугом в отсутствии терапии. Но не исключается вероятность прогрессирования заболевания, что, собственно, и приводит к развитию онкологического процесса.
Общая информация
Что же представляет собой данный вид патологии женского организма и какая существует опасность? До 1975 года заболевание носило отличное наименование – дисплазия. При развитии патологического процесса характеристики митоза клеточного ядра и цитоплазмы эпителия подвергаются существенным изменениям. В то же время мембрана и верхние его слои остаются нетронутыми.
При определенных обстоятельствах цервикальная интраэпителиальная неоплазия преобразуется в злокачественное новообразование. И если своевременно не начать лечебную терапию, дальнейшее развитие заболевание представляет серьезную угрозу жизни. Предраковое состояние обусловлено активацией вируса папилломы человека (ВПЧ), который присутствует в организме практически каждого человека. При этом специалисты выделяют несколько разновидностей вируса, что еще больше усугубляет положение.
Многие люди зачастую путают два понятия, называя дисплазию эрозией. Но это не совсем так, поскольку последний термин не до конца передает всю суть происходящего. Дело в том, что эрозия возникает по причине повреждения тканей механического характера, а дисплазия – это уже нарушение клеточной их структуры.
Каждый год по всему миру примерно 40 млн женщинам ставится диагноз "цервикальная интраэпителиальная неоплазия шейки матки", что составляет от 15 до 18 процентов из всех случаев патологий детородного органа. При этом в большинстве случаев риску подвергаются молодые девушки возрастом 25-35 лет. Соотношение заболеваемости составляет в среднем два человека на одну тысячу населения.
Как устроена шейка матки
Чтобы четко понимать и осознавать всю опасность патологии, стоит хорошо разбираться в анатомии женского организма, в частности шейки матки. Этим термином зовется нижняя часть детородного органа узкой и цилиндрической формы. Частично она расположена в брюшной области и немного заходит в зону влагалища, иными словами, она расположена на обоих участках.
Для осмотра влагалищной части гинекологи пользуются специальными зеркалами. Во внутренней части шейки располагается узкий цервикальный канал длиной 10-15 мм. Наружный зев переходит непосредственно во влагалище, тогда как внутренний обращен в полость матки. Иными словами, это своего рода небольшой туннель, который соединяет влагалище с детородным органом. Для осмотра влагалищной части с целью обнаружения цервикальной интраэпителиальной неоплазии шейки матки гинекологи пользуются специальными зеркалами.
Цервикальный канал устлан цилиндрическими эпителиальными клетками ярко-красного цвета. Внутри них расположены специальные железы, выделяющие слизь, которая служит защитой от разного рода болезнетворных микроорганизмов.
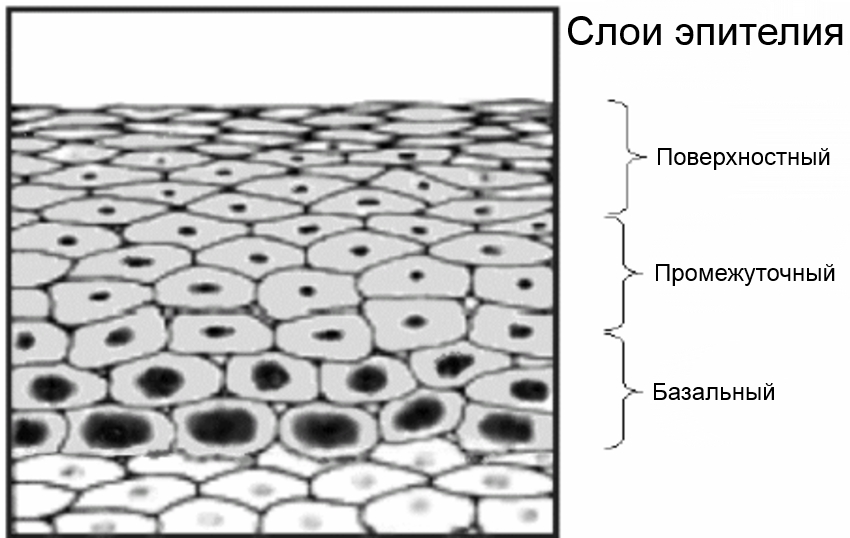
В области наружного маточного зева цилиндрические клетки сменяются плоскими. Желез здесь нет, а оттенок уже розоватый. При этом данный эпителий образован несколькими слоями:
- Базально-парабазальным – самая нижняя граница, образованная, в свою очередь, базальными и парабазальными клетками. Под базальной тканью расположена мышечная структура, сосуды, нервные окончания. Также здесь есть молодые клетки, которые могут делиться.
- Промежуточным.
- Поверхностным (функциональным).
Здоровые базальные клетки имеют округлую форму, внутри них располагается большое ядро. Постепенно созревая, они поднимаются к верхнему слою. При этом их форма уплощается, в то время как ядра уменьшаются в размерах. Когда клетки добираются до верхнего слоя, они становятся более плоскими с небольшими ядрами.
При цервикальной интраэпителиальной неоплазии 1, 2, 3 степени строение клеток уже немного отличается — появляются атипичные элементы, которые не обладают какой-либо определенной формой, а размер их очень большой. К тому же каждая такая клетка обладает несколькими ядрами, а их деление происходит еще быстрее.
В случае патологического процесса затрагиваются разные слои эпителия, кроме поверхностного. Измененные клетки активно разрастаются, и на фоне этого формируются признаки ядерной атипии.
Классификация патологии
Неоплазия классифицируется на несколько степеней, в зависимости от тяжести патологии и количества вовлеченных клеток покровного эпителия:
- I степень – легкая (CIN1).
- II степень – умеренная (CIN2).
- III степень – тяжелая (CIN3).
На территории Российской федерации врачи в основном пользуются этой классификацией И. А. Яковлевой и Б. Г. Кукутэ 1977 года.
Легкая неоплазия
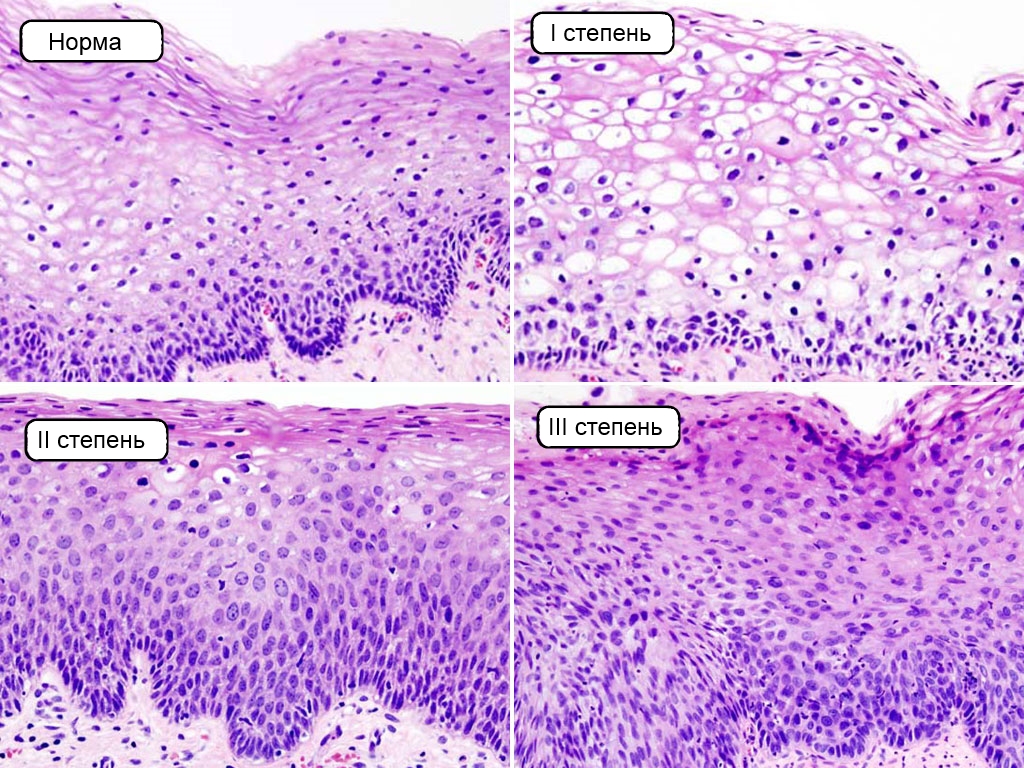
Это слабая цервикальная интраэпителиальная неоплазия, при которой структура тканей изменена незначительно, присутствуют койлоциты. Также наблюдается слабо выраженная степень разрастания базальных клеток. Патологический процесс затрагивает не более трети толщины эпителия.
Дисплазия умеренной степени
Здесь речь идет о более выраженном патологическом процессе, который уже охватывает до 2/3 толщины слизистой оболочки шейки матки. На нижних и средних слоях эпителия присутствуют атипичные клетки.
Тяжелый случай
При этом поражается чуть ли не вся толщина эпителия. В данном случае четкого разделения на слои уже не прослеживается. Помимо этого, можно обнаружить патологические изменения митоза и акантоза.
Причины возникновения
Чтобы ВПЧ привел к развитию онкологического процесса, требуется ряд факторов. Стоит заметить, что этот вирус не у каждой женщины может спровоцировать появление цервикальной интраэпителиальной неоплазии 1 степени. Как правило, начиная с момента заражения ВПЧ или его активации и заканчивая появлением предракового состояния, проходит примерно от 1,5 до 5 лет. Непосредственно сам онкологический процесс формируется годами либо десятилетиями.
Что касается развития неоплазии шейки детородного органа, то появление патологии обусловлено не одним, а несколькими факторами, как в случае любого другого предракового состояния. Здесь речь идет о целом сочетании провоцирующих причин:
- Заражение определенной разновидностью ВПЧ.
- Применение гормональных противозачаточных препаратов в течение длительного периода времени (5 лет и более).
- Начало ранней половой жизни (14-15 лет).
- Близость со многими партнерами.
- Наличие вредных привычек (курение, не только активное, но и пассивное).
- Слабый иммунитет.
- Хирургические вмешательства и аборты, причем неоднократно.
- Нарушение гормонального баланса.
- Половые заболевания инфекционного характера.
- Наследственная предрасположенность.
Но как уже выше было отмечено, зачастую появление цервикальной интраэпителиальной неоплазии провоцирует именно папиллома-вирус. Причем заболевание может начать развиваться с отсутствием симптомов и, как правило, с момента возникновения дисплазивных процессов и до начала онкологического новообразования проходит до 10 лет.
Заражению этого вируса подвержен каждый человек, но в особенности это касается тех женщин, которые ведут активную половую жизнь с несколькими партнерами. Пренебрежительное отношение к контрацептивам, а также игнорирование лечения воспалительных процессов органов репродуктивной системы – все это только повышает риски развития патологии. К тому частые роды или аборты приводят к получению травм шейки матки.
Симптоматика
Опасность цервикальной интраэпителиальной неоплазии 2 степени или более тяжелой заключается в том, что в большинстве случаев женщина просто не ощущает характерных признаков начавшихся патологических изменений эпителия. Женщина при этом не чувствует боли, повышения температуры тела тоже нет, равно как и ухудшения состояния.
Симптомы если и появляются, то это уже будет свидетельствовать о наличии присоединительной инфекции, которая приводит к развитию ряда заболеваний:
- Воспаление шейки матки (цервицит).
- Воспалительный процесс мочеполовой системы вследствие воздействия трихомонад (трихомониаз).
- Воспаление влагалища (кольпит).
В этом случае женщина будет чувствовать зуд и жжение во влагалище, кровянистые выделения после полового акта, спринцевания или использования тампонов. Бели могут также изменять консистенцию, запах и цвет (густые, обильные и неприятно пахнут). При цервикальной интраэпителиальной неоплазии тяжелой степени возможно появление болевых ощущений в области матки тянущего характера.

Регулярный гинекологический осмотр женщин с использованием инструментального, лабораторного и клинического исследования позволит своевременно обнаружить патологию и начать лечение.
Диагностирование
Как мы теперь знаем, неоплазия при определенных обстоятельствах грозит перейти к развитию раковой опухоли. По этой причине ранняя диагностика позволит избежать серьезных осложнений. Любой женщине старше 21 года необходимо ежегодно посещать гинеколога с целью планового осмотра, а через каждые три года проходить цитологическое обследование.
Эффективные методики диагностирования:
- Гинекологический осмотр.
- Кольпоскопия.
- Прицельная биопсия.
- Гистология биоптата.
- Цитология мазка по Папаниколау.
Цель гинекологического осмотра заключается в выявлении видимых визуально изменений слизистой оболочки. При этом в редких случаях (3-4 %) такой осмотр не дает должного результата. Но в основном у женщин (20-24 %) могут быть обнаружены признаки цервикальной интраэпителиальной неоплазии 1 степени в лице ретенционной кисты, очаговой либо диффузной гиперемии слизистой шейки. При тяжелой форме патологии зачастую (64–73 %) выявляются характерные признаки: эрозия, псевдоэрозия, лейкоплакия разной степени ороговения, экзофитные разрастания эпителия.
Кольпоскопия осуществляется специальным оптическим аппаратом (кольпоскопом), который способен увеличивать объекты в 10 и более раз. С его помощью можно не только проводить диагностику, но и выполнить пробы. То есть провести обработку шейки детородного органа раствором Люголя либо уксусной кислоты.
Прицельная биопсия ведется в ходе процедуры кольпоскопии. При этом берется проба путем отсекания кусочка ткани в проблемной зоне.
Гистология биоптата представляет собой гистологическое исследование взятой при биопсии пробы. Данная методика считается самой эффективно в обнаружении патологии.
Мазок Папаниколау изучается под микроскопом, где можно обнаружить атипичные клетки, а также маркеры ВПЧ, что свидетельствует о цервикальной интраэпителиальной неоплазии 2 степени.
Помимо этого, в обязательном порядке проводится УЗИ половых органов женщины. А в качестве дополнительных мер предлагается ПЦР-исследование и анализ крови на иммунный статус.
Способы лечения
Выбор способа лечения во многом зависит от нескольких факторов:
- возраст пациентки;
- тяжесть патологии;
- какова зона поражения;
- имеются ли сопутствующие заболевания;
- наличие аллергических проявлений на медицинские препараты.
Если патология слабо выражена, то проводятся динамические наблюдения, а при обнаружении какой-либо инфекции назначается специальная терапия. Стоит заметить, лечение начальной стадии неоплазии ведется с использованием медицинских препаратов, однако при диагностировании цервикальной интраэпителиальной неоплазии 2 и 3 степени тяжести показано лишь хирургическое вмешательство.
Использование медикаментов
Поскольку лечение неоплазии осуществляется в основном путем хирургического вмешательства, то использование медикаментов ведется в качестве вспомогательной терапии.
Связано это главным образом с тем, что на начальном этапе развития патологии какие-либо характерные признаки отсутствуют. Задача медицинских препаратов в данном случае сводится к следующему:
- Повысить силы иммунитета.
- Нормализовать вагинальную микрофлору.
- Устранение гормонального дисбаланса.
- Подавление активности ВПЧ в организме.
- Терапия инфекций, передающихся половым путем (ИППП).
Что касается самих медикаментов, то обычно врач назначает "Интерферон", "Продигиозан", "Циклоферон", "Гроприносин", "Кагоцел", "Генферон" и ряд прочих препаратов. Если учесть одну особенность ВПЧ, которая заключается в подавлении выработки собственного интерферона лейкоцитами, причем значительно, то выбор данных медикаментов для лечения цервикальной интраэпителиальной неоплазии (CIN 1) вполне обоснован.
В качестве противовирусного средства хорошей эффективностью отличается "Панавир". Нормализовать влагалищную флору можно при помощи пробиотиков с бифидо- и лактобактериями. Терапия ИППП ведется с применением антибиотиков, исходя из разновидности патогенного микроорганизма. Помимо этого, назначается прием витаминов группы В, антиоксидантов, омега-кислот.
В то же время не всегда удается полностью победить патологию, и по этой причине в большинстве случаев врачи все-таки направляют пациенток на проведение операции. Только перед такой процедурой и после нее необходим поддерживающий курс терапии с использованием медикаментов.
Хирургия
В зависимости от индивидуальных особенностей женского организма, списка противопоказаний, размеров зоны поражения, назначаемое хирургическое вмешательство может быть разного вида.
- Лазерное иссечение. Данная методика лечения цервикальной интраэпителиальной неоплазии 3 степени осуществляется посредством лазерного скальпеля, которым собственно иссекается пораженные ткани.
- Радиоволновая терапия. Считается новой методикой, при которой пораженный участок удаляется путем воздействия радиоволн высокой частоты. Для операции привлекается аппарат "Сургитрон".
- Электроконизация. Здесь процедура выполняется при помощи металлической петли, куда подается электрический ток. При этом удаляется пораженный конусообразный участок пораженной с включением здоровой ткани. Операция широко используется при лечении неоплазии шейки матки. Она может проводиться и лазерным методом, что удается свести к минимуму риски кровотечений. Проводится операция после месячных.
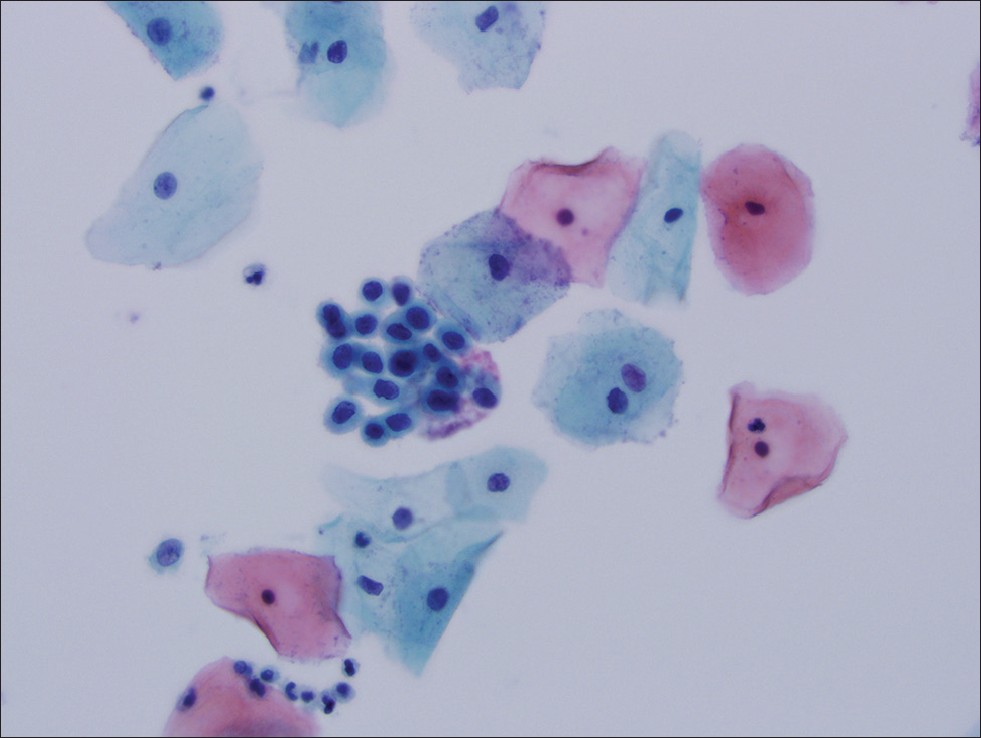
- Фотодинамическая терапия. Тоже является современным способом лечения неоплазии. Работает методика следующим образом: после введения в организм фотосенсибилизатора, он начинает скапливаться в новообразовании. При этом в тканях с измененной структурой выделяется синглетный кислород, который и приводит к гибели атипичных клеток.
- Диатермокоагуляция и криодеструкция. Эти методики температурного воздействия в отношении цервикальной интраэпителиальной неоплазии 3 степени используются в крайне редких случаях, что обусловлено отсутствием контроля глубины и объема воздействия со стороны врача. И поэтому появление рецидива в этом случае не избежать. Обычно прижигание или замораживание применяется только к фоновым патологиям, но никак не предраковым.
На основе данных, полученных от гистологического исследования, специалист уже принимает дальнейшие решения. При обнаружении раковых клеток, вероятно, потребуется дополнительная операция или проведение лучевой терапии, химиотерапии.
Возможные последствия
Грамотное лечение неоплазии начальной степени способствует подавлению репликации ВПЧ, в результате чего наступает выздоровление. Однако отсутствие должного лечения грозит развитием серьезных осложнений. Бесконтрольное прогрессирование патологии лишь усугубляет ее протекание, а время перехода I или II стадии патологии в цервикальную интраэпителиальную неоплазию 3 степени шейки матки зависит от индивидуальных характеристик человека, его местного и общего иммунитета.
Умеренная стадия патологии тоже еще подается лечению, только в этом случае курс будет более длительным, и операция зачастую может проводиться не один раз. Самая тяжелая степень неоплазии может формироваться в онкологическое новообразование с вероятностью 50 %.
Однако самым угрожающим осложнением является формирование инвазивной формы рака. На начальной стадии процесс выглядит безобидно. На слизистой оболочке это проявляется в виде покраснения. И зачастую в ходе более детальной диагностики определяется хаотичное деление клеток эпителия. И если дать этому процессу спокойно развиваться, впоследствии формируется опухоль небольшого размера, которой потом ничего не мешает увеличиваться, что приводит к распространению метастазов.

Такое может произойти после тяжелой цервикальной интраэпителиальной неоплазии при поздней диагностике либо при игнорировании лечения по каким-либо причинам.
Патология и беременность
При неоплазии шейки органа деторождения это не является противопоказанием, чтобы продлить беременность, но в то же время протекание атипического процесса заметно усугубляется. В период вынашивания ребенка лечение важно как никогда, ведь при активации ВПЧ из-за снижения иммунитета женского организма микроорганизм может достигнуть плода, что приводит к внутриутробному инфицированию.
К тому же практически все типы вируса впоследствии способствуют поражению гортани ребенка. Во время родов не исключен риск попадания ВПЧ в дыхательные пути ребенка, из-за чего развивается такое респираторное заболевание, как папилломатоз.
Альтернативная методика
Все мы знаем, какой эффективностью обладают народные рецепты для лечения различных заболеваний. Неоплазия шейки матки не является исключением, но лучше перед проведением такой терапии получить консультацию у своего лечащего врача. Только стоит учитывать, что, как в случае с применением медикаментов, лечение цервикальной интраэпителиальной неоплазии высокой степени тяжести неэффективно, а порой даже бессмысленно.
Бороться с патологией можно при помощи настоя из сбора определенных видов трав. Для его приготовления следует взять 1 ч. л. донника, 2 ч. л. тысячелистника, 3 ч. л. крапивы, такое же количество плодов шиповника, по 4 ч. л. цветков календулы и таволги. Все ингредиенты хорошо перемешать, после чего 1 ст. л. смеси залить стаканом кипятка и дать настояться 30 минут. При помощи этого настоя делать спринцевание по утрам и вечерам, а в качестве дополнения следует вставлять во влагалище тампоны от 30 до 40 минут, смоченные в этом же растворе. Проводят манипуляции в течение месяца.

Не меньшей эффективностью обладает облепиховое масло. Им тоже следует пропитать тампон и вставлять на ночь в течение 60-90 дней. Также для этих целей можно использовать сок алоэ, только в этом случае использовать тампоны необходимо два раза в день, а курс – 1 месяц.
ДИСПЛАЗИЯ ШЕЙКИ МАТКИ – ЭТО ПРЕДРАКОВЫЙ ПРОЦЕСС, ХАРАКТЕРИЗУЮЩИЙСЯ НАРУШЕНИЕМ СОЗРЕВАНИЯ МНОГОСЛОЙНОГО ПЛОСКОГО ЭПИТЕЛИЯ В РЕЗУЛЬТАТЕ ДЛИТЕЛЬНОЙ ПЕРСИСТЕНЦИИ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА.
Синонимы: цервикальная интраэпителиальная неоплазия (CIN), плоскоклеточное интраэпителиальное поражение (SIL).
Если коротко, дисплазия шейки матки — это заболевание, которое в будущем может привести к раку. Вероятность этого тем выше, чем выше степень дисплазии. К дисплазии 1 степени (CIN 1, LSIL) относят любые изменения эпителия, порой даже минимальные и субъективные. Это позволяет взять женщину под контроль и не допустить прогрессирования процесса. На практике, для диагностики дисплазии 1 степени достаточно поражение эпителиальных клеток вирусом папилломы человека. Опасаться этого не стоит! Легкая степень дисплазии самостоятельно проходит у 70% женщин в течение нескольких лет. За это время собственная иммунная система уничтожает вирус и заболевание регрессирует. Обычно дисплазия 1 степени требует только наблюдения, в части случаев может назначаться прижигание. Дисплазия 2 и 3 степени (CIN 2-3, HSIL) — это уже предопухолевый процесс с высоким риском, поэтому требует серьезного лечения. В таких случаях показана широкая эксцизия или конизация шейки матки. Диагностировать дисплазию эпителия можно с помощью мазка на цитологию или биопсии. В принятии решения и тактике лечения важную роль играет тест на ВПЧ.
Подробнее читайте ниже, а также посмотрите комментарии, там Вы найдете ответы на свои вопросы.
Основной причиной развития дисплазии шейки матки является вирус папилломы человека, а именно его онкогенные штаммы — 14 серотипов, среди которых наиболее важными являются 16 и 18. Зрелый многослойный плоский эпителий, покрывая наружную часть шейки, создает непреодолимую преграду для вируса. Единственным же уязвимым местом является граница с железистым эпителием у наружного зева, называемая зоной трансформации . При эрозии (эктопии) шейки матки зона трансформации смещается на наружную часть шейки матки, что создает предпосылки для инфицирования.
Более 80% случаев дисплазии и рака шейки матки развивается именно в зоне трансформации.
Большинство женщин переносит ВПЧ-инфекцию без каких либо изменений со стороны организма. В течение нескольких лет иммунная система самостоятельно избавляется от вируса. Однако 10% женщин не могут уничтожить вирус, который в свою очередь встраивается в ДНК эпителиальных клеток и модифицирует их, приводя к опухолевой трансформации. Это может быть связано как с индивидуальной предрасположенностью, так и с иммунодефицитом или длительными стрессами. Также известно, что курение способствует снижению специфического иммунитета против ВПЧ.
Дисплазия шейки матки — это качественное изменение клеток плоского эпителия, которое указывает на возможное начало опухолевой трансформации.
Степени дисплазии шейки матки и терминология (CIN, LSIL, HSIL)
Различают несколько степеней дисплазии шейки матки по тяжести, что обычно выражается в числовых значениях от 1 до 3. Каждая степень отражает прогноз патологического процесса и позволяет выбрать соответствующий алгоритм лечения. Так, дисплазия 1 степени имеет низкий потенциал к малигнизации и в большинстве случаев самостоятельно регрессирует в течение нескольких лет без какого-либо вмешательства. В противоположность, дисплазия 3 степени в течение одного года обязательно трансформируется в рак и требует уже специализированного хирургического лечения.

Прогрессирование дисплазии шейки матки
В международной практике термин “дисплазия шейки матки” имеет различные синонимы. Наиболее широко распространена аббревиатура CIN – цервикальная интраэпителиальная неоплазия, что означает развитие неоплазии (новообразования) в пределах эпителиального пласта. В отличие от рака, CIN не обладает способностью к инвазивному росту и метастазированию. На этом этапе можно предотвратить развитие злокачественной опухоли.
В 1988 г. была создана новая терминология — «SIL» (squamous intraepithelial lesion), что означает «плоскоклеточное интраэпителиальное поражение». Специалисты отказались от некорректного при данной патологии слова «неоплазия» и заменили его на «поражение». Степени тяжести процесса выделили всего две: легкую LSIL и тяжелую HSIL:
1) LSIL (low grade squamous intraepithelial lesion) — плоскоклеточное интраэпителиальное поражение легкой степени. LSIL соответствует CIN 1 или дисплазии 1 степени.
2) HSIL (hight grade squamous intraepithelial lesion) — плоскоклеточное интраэпителиальное поражение тяжелой степени, что соответствует CIN 2 и CIN 3. Умеренная и тяжелая дисплазия объединены в одну категорию, поскольку требуют одинакового подхода к лечению, а различия в некоторых случаях достаточно субъективны. Термин «рак in situ» сейчас практически не используется, по новой классификации отнесен в группу тяжелых интраэпителиальных поражений плоского эпителия.
| Pap class System 1954 | Классификация ВОЗ 1956 | Классификация Bethesda 1988 |
| Class | Дисплазия/CIN (ЦИН — цервикальная интраэпителиальная неоплазия) | SIL (плоскоклеточное интраэпителиальное поражение) |
| Class 3 | Дисплазия 1 степени/CIN 1 | LSIL — плоскоклеточное интраэпителиальное поражение легкой степени |
| Дисплазия 2 степени/CIN 2 | Дисплазия 3 степени/CIN 3 | |
| Рак in situ (рак в пределах эпителиального пласта, без инвазивного роста) |
Диагностика
1. Мазок на цитологию

Первым методом в диагностике дисплазии шейки матки чаще всего является мазок на онкоцитологию . Это скрининговый метод для обследования большого количества женщин. Является самым простым и безопасным для женщины, однако не самым точным. Чувствительность метода составляет 60-70%, и только трехкратное исследование позволяет с высокой точностью определить или опровергнуть дисплазию эпителия. Кроме этого у молодых женщин часто бывают ложно-отрицательные результаты, когда дисплазия может быть пропущена; а у пожилых женщин часты ложно-положительные результаты, когда мазок показывает наличие дисплазии, в то время как более качественные методы ее исключают.
При определении LSIL в мазке необходимо только лишь активное наблюдение. Под этим диагнозом подразумеваются клеточные изменения с низким потенциалом опухолевой трансформации. К LSIL относятся различные дегенеративные изменения клеток при раздражении, воспалении или вирусном поражении. Гинеколог, получив такое заключение может порекомендовать проведение кольпоскопии с последующей точечной биопсией.
При наличии HSIL в мазке на цитологию проведение кольпоскопии с гистологическим подтверждением становится обязательным!
2. Кольпоскопия
Кольпоскопия — это метод осмотра наружной поверхности шейки матки с помощью специального микроскопа. Кольпоскопия является достаточно субъективным методом диагностики, сильно зависящим от опыта и умения врача. Кольпоскопические картины дисплазии шейки матки размыты и очень часто ее можно спутать с банальными физиологическими процессами, такими как плоскоклеточная метаплазия, вирусным поражением или лейкоплакией. Несмотря на это, кольпоскопия позволяет определить подозрительные места на шейке матки и взять биопсию — участок ткани для дальнейшего гистологического исследования.
К кольпоскопическим признакам дисплазии относятся: ацетобелый эпителий, йод-негативные зоны, изъеденность или нерегулярность эпителиального покрова, атипичные сосуды, мозаика, пунктация, контактная кровоточивость и др. Гинеколог должен оценить не только степень, но и скорость наступления тканевой и сосудистой реакции при обработке уксусной кислотой или йодом.
Цель кольпоскопии — это определить анатомическую локализацию зоны трансформации, что имеет решающее значение для дальнейшей тактики диагностики и лечения.
3. Биопсия
Биопсия является “золотым” стандартом диагностики дисплазии и рака шейки матки. Гистологическое исследование позволяет определить качество плоского эпителия и степень его созревания. Биопсия может быть точечной, получаемой с помощью специального инструмента — конхотома, или широкой (эксцизионной), получаемой с помощью электропетли.
Изменения при дисплазии 1 степени обычно носят характер цитопатического действия вируса папилломы человека. В эту категорию так же относят остроконечную и плоскую кондиломы. Морфологические изменения при CIN 1 (LSIL) включают: нарушение стратификации плоского эпителия преимущественно в базальных отделах, нарушение поляризации клеток относительно базальной мембраны, единичные делящиеся клетки, незначительный дискариоз, а также признаки вирусного поражения — койлоцитарную атипию в поверхностных отделах эпителия, дискератоз, пара- и гиперкератоз эпителия.

Патологическая эпидермизация желез с CIN III
Морфологические изменения при CIN 2-3 (HSIL) носят уже неопластический характер, а цитопатическое действие вируса может проявляться слабо. Нарастает клеточная атипия, которая затрагивает весь пласт плоского эпителия с минимальными признаками созревания. Клетки активно делятся, замещая нормальный эпителий цервикальных желез, в ряде случаев пролиферирующий плоский эпителий может замещать выстилку цервикального канала. Характерно обилие как нормальных, так и патологических митозов.
Тяжелая дисплазия шейки матки отличается от рака отсутствием инвазивного роста.
Нужен ли тест на ВПЧ?
Тест на ВПЧ помогает в диагностике дисплазии шейки матки и выборе тактики лечения в сложных ситуациях.
ВПЧ тест рекомендуется делать женщинам после 25 лет, поскольку имеется большая вероятность, что инфекция уже длительное время персистирует в организме и могла вызвать какие-либо изменения в шейке. В более молодом возрасте при нормальном мазке на цитологию ВПЧ-тистирование не дает полезной информации.
С возрастом ВПЧ-тестирование приобретает все большую значимость. К примеру, при наличии 16 или 18 штаммов ВПЧ у 50 летней женщины можно с высокой вероятностью утверждать, что у нее уже имеется тяжелое интраэпителиальное поражение эпителия. Мазок на цитологию менее эффективен в данном случае. Женщине тот час может рекомендоваться диагностическая биопсия и выскабливание цервикального канала.
Лечение дисплазии шейки матки
Тактика лечения и ведения пациенток с дисплазией зависит от гистологического заключения, кольпоскопической картины, типа зоны трансформации, возраста и планирования беременности. Основными методами являются абляция (прижигание), или эксцизия (удаление тканей). Эти методы могут проводиться с помощью различных инструментов, использующих низкие или высокие температуры, электро-, лазеро- или радиоволновую энергию.
Лечение LSIL (CIN 1):
По западным протоколам LSIL необходимо динамически наблюдать. Так как LSIL обладает низким злокачественным потенциалом и часто регрессирует самостоятельно, женщине рекомендуется проходить цитологическое исследование не менее 2 раз в год. В отечественной медицине часто рекомендуют абляцию (прижигание), хотя это не всегда оправдано. С прижиганием связывают некоторое повышение риска невынашивания беременности. Однако, часть авторов, опровергает это.
Наиболее оптимальным является радиоволновая абляция Сургитроном. Патологический эпителий и подлежащая строма выпариваются радиоволнами, после чего пораженная зона эпителизируется заново. Минусом абляции является отсутствие материала для последующего гистологического исследования, плюсом — сохранение анатомического строения шейки матки и небольшое количество осложнений.
Лечение HSIL (CIN 2, CIN 3):
HSIL обладает высоким злокачественным потенциалом, поэтому в данном случае показано удаление патологически изменненых тканей. Обычно, рекомендуется широкая эксцизионная биопсия или конизация шейки матки — это конусообразное удаление тканей, включающая наружную часть шейки матки и ткани вокруг цервикального канала. Весь удаленный материал отправляется на гистологическое исследование для подтверждения и уточнения диагноза. В удаленном материале гистолог оценивает края резекции, так как важно, чтобы патологический эпителий был удален в пределах здоровых тканей. При наличии в краях резекции патологии, или глубоком поражении цервикального канала, а также наличии инвазивного роста может быть принято решение об ампутации шейки матки.
Изредка, если женщина молода и планирует беременность, допускается лечение HSIL абляцией. Это возможно только лишь в случае 1 или 2 типа зоны трансформации при кольпоскопии, когда гинеколог видит глазом все измененные ткани и может обеспечить полную их абляцию. Если зона трансформации смещена глубоко в цервикальный канал — показана только глубокая конизация или ампутация шейки матки.
Частота интраэпителиальной неоплазии шейки матки, или CIN, коррелирует с сексуальной активностью женщины. Благодаря ежегодному профилактическому цитологическом исследованию эпителия шейки матки с
Папаниколау, в развитых странах мира смертность от инвазивного рака шейки матки снизилась на 90%, и большинство случаев заболевания обнаруживают именно на стадии CIN.
Патогенез. Единственным доказанным фактором риска CIN и рака шейки матки является вирус папилломы человека (ВПЧ-серотипа 16, 18, 31 и 45). В пораженных клетках плоского эпителия шейки матки ДНК ВПЧ обнаруживается в 90% случаев. Основными трансформируя агентами ВПЧ-индуцированного канцерогенеза шейки матки является онкопротеинов ВПЧ Е6 и Е7. В случае инфицирования ВПЧ цервикальной интраэпителиальной неоплазии имеет больший риск прогрессирования в инвазивный рак.
Клиника и диагностика. Заболевание обычно бессимптомное. Скрининг CIN заключается в цитологическом исследовании клеток эпителия шейки матки в зоне трансформации у наружного зева с помощью плоского шпателя. Материал обязательно принимают также из цервикального канала с помощью специальной цервикальной щеточки, переносят его на предметное стекло и затем проводят цитологическое исследование (скрининговое цитологическое исследование по Папаниколау выполняют ежегодно всем сексуально активным женщинам, а также тем, что достигли 18 лет). Исследование выявляет 6 типов изменений: 1) нормальный клеточный материал; 2) инфекция; 3) воспалительные изменения;
4) дисплазия; 5) рак — 6) инвазивный рак. Окончательный диагноз устанавливается по результатам биопсии.
Дисплазия (аномальная дифференциация — атипия клеток эпителия над базальной мембраной) классифицируется по степени зависимости от распространения атипичных изменений в толще эпителия: дисплазия I степени при атипичных изменениях (дискариоз, увеличение плеоморфизму, митозов, аномальные митозы, увеличение размеров ядер и уменьшение цитоплазмы) до 1 / 3 толще эпителия, дисплазия II — до 2/3 и дисплазия III, или рак — при поражении более 2/3 эпителия к базальной мембраны (25.7, 25.8). Рак означает тяжелую дисплазию с поражением всей толщи эпителия, но к базальной мембраны (без инвазии). При отсутствии лечения рак прогрессирует в инвазивную болезнь в 15-33% случаев в течение 10 лет. Современная классификация плоскоклеточных поражений (Bethezda system) включает такие варианты эпителиальных аномалий:
1) атипичные плоские клетки (ASC, atypical squamous cells), атипичные плоские клетки с неясным значением (ASCUS, atypical squamous cells with undetermined significance), атипичные плоские клетки, не исключают плоскоклеточное интраэпителиальное поражения высокой степени риска (ASC-H, atypical squamous cells can not exclude high grade)
2) плоско клеточное интраэпителиальное поражения низкой степени риска (LSIL, low grade squamous intraepithelial lesion)]
3) плоскоклеточное интраэпителиальное поражения высокой степени риска (HSIL, hig / i grade squamous intraepithelial lesion)]
4) плоскоклеточный рак (SCC, squamous cell carcinoma)]
5) атипичные железистые клетки (AGC, atypical glandular cells)]
6) атипичные железистые клетки, скорее неопластические;
7) эндоцервикальная рак;
8) аденокарцинома.
По Bethezda system также обнаруживаются микроорганизмы (трихомонады, кандиды, бактериальный вагиноз, актиномикоз), клеточные изменения, ассоциированные с вирусом герпеса, реактивные воспалительные изменения, железистые клетки после гистерэктомии, атрофические и другие ненеопластични изменения.
Термины «дисплазия», «интраэпителиальная неоплазия» и «плоскоклеточное интраэпителиальное поражения» являются синонимами и используются в различных классификациях (25.1; 25.7).
Известно, что ASC и LSIL могут возникать вследствие преходящих воспалительных изменений, в том числе вызванных ВПЧ. Около 80-85% случаев ASC и LSIL спонтанно регрессируют через 1-2 года, но 10-15% могут прогрессировать в рак; HSIL чаще ассоциируется с персистирующей ВПЧ и прогрессирует в инвазивный рак.
При выявлении ASCUS пациенткам проводят скрининг на ВПЧ-16, ВПЧ-18, кольпоскопию с прицельной биопсией. При отсутствии ВПЧ повторное исследование рекомендуют через 1 год, повторную кольпоскопию и цитологический анализ — через 4 6 мес. При наличии ASC-H, LSIL и HSIL выполняют кольпоскопию и прицельную биопсию.
Кольпоскопия используется для идентификации патологических изменений эпителия шейки матки с целью прицельной биопсии поражений. Термин «удовлетворительная кольпоскопия» означает, что плоскоклеточный-цилиндрическое соединение и патологический эпителий полностью визуализируются. При «неудовлетворительной кольпоскопии» полная визуализация патологического эпителия невозможна, что нередко случается при атрофии или воспалительной реакции. Эпителий эктоцервикса с признаками CIN может проявляться как ацетобилий (белые пятна после аппликации 3% -го раствора уксусной кислоты), в виде мозаики, пунктация, лейкоплакии (25.2, 25.9).
Патологический эпителий содержит большее количество великоядерних клеток, которые отражают свет и поэтому имеют непрозрачный вид при аппликации уксусной кислоты (ацетобилий эпителий) и светлый вид (йод-отрицательный эпителий) при аппликации раствора Люголя вследствие уменьшения количества гликогена в цитоплазме. Участки лейкоплакии, пунктация, мозаики или атипичных сосудов могут выявлять злокачественные изменения, поэтому биопсия является обязательной. Биопсию шейки матки выполняют с помощью цервикальных щипцов, скальпеля (с наложением лигатуры или без нее), электрохирургических инструментов, С02-лазера.
Лечение. В связи с риском прогрессии в инвазивный рак (LSIL через 7 лет и HSIL — через 4 года) лечение плоскоклеточных интраэпителиальными поражений является хирургическим. При обнаружении ASC-H, LSIL назначают контрольное кольпоскопическое исследования каждые 4-6 мес. В случае их регрессии пациентку подвергают ежегодном профилактическом цитологическом исследованию. При длительной персистенции LSIL (в течение 1-2 лет), а также при наличии HSIL выполняют хирургическую деструкцию или эксцизии (конизацию) пораженной ткани шейки матки в пределах здоровых тканей.
Хирургическая эксцизия (конизация) шейки матки может выполняться по любой методике:
• Конизация шейки матки скальпелем с удалением ее конусообразной части с восторгом стромы шейки матки и цервикального канала
• электрохирургической петлевая эксцизия (LEEP- loop electrosurgical excision procedure) и широкая петлевая эксцизия зоны трансформации (LLETZ — large loop excision of the transformation zone)
• Петлевая электрическая эксцизия с селективной двойной эксцизией («top hat ‘- процедура)
• С02-лазерная конусообразная эксцизия зоны трансформации
• Комбинированная конизация
При небольших поражениях, ограниченных экзоцервикса, при условии исключения инвазивного заболевания, выполняют петлевой эксцизии, криодеструкцию или лазерную вапоризацию видимых поражений без чрезмерной травмы шейки матки. Умеренная и тяжелая дисплазия редко прогрессирует более чем на 1-1,5 см в эндоцервикальная канал; железистые поражения не проникают в строму более 3-3,5 мм. Итак, высота конуса обычно не превышает 15 мм, а периферич края вокруг канала — 3,5-5 мм. При легкой дисплазии высота конуса может достигать 8-10 мм, периферические края — 3 мм.
Холодная конизация (скальпелем). Успех операции во многом определяется видимостью операционного поля, качеством его освещения, достижением тщательного гемостаза. Перед операцией выполняют расширенную кольпоскопию для точного определения краев поражения. Гемостаза достигают путем инъекции в шейку матки вазоконстрикторного раствора (0,01% раствор адреналина или вазопрессина) или наложением гемостатических швов «на 3 и на 9:00», также помогает лучшей экспозиции оперативного поля. Скальпель направляют в цервикального канала с захватом стромы на глубину 1,5 см. Операцию можно дополнить кюретажем цервикального канала. Гемостаза достигают с помощью электрокоагуляции шариковым электродом (50 Вт). Швы с шейки матки срезают, тампон во влагалище не вводят.
Лазерная конизация шейки матки выполняется по сходной методике. Как скальпель используют луч С02-лазера. Для уменьшения кровоточивости тканей выполняют инъекцию вазоконстрикторного агента. Сначала лазерным лучом диаметром 1-1,5 мм и мощностью 40-60 Вт замечают линию эксцизии с захватом зоны трансформации (25.10) и удаляют конус. Преимуществами лазерной эксцизии является меньшая кровопотеря, более прецизионная техника, недостатками — большая затрата времени и термальная травма, может влиять на результаты гистологического исследования.
Электрохирургическая петлевая эксцизия (конизация) — это офисная процедура. После кольпоскопии и определения зоны трансформации и краев поражения, в шейку матки вводят раствор вазоконстрикторного агента с лидокаином (1: 100 адреналин или вазопрессин). Выбирают петлевой электрод соответствующего размера, размещают его в положении «на 6:00» и активируют (мощность 50-60 Вт) при перемещении вертикально «на 12:00» (25.11). Петля высекает слизистую оболочку в зоне трансформации на глубину 10 мм. Коагуляцию участка эксцизии (кратера) осуществляют шариковым электродом.
Петлевая электроконизация с селективной двойной эксцизией («top hat» -процедура). При наличии HSIL, а также при локализации поражения в эндоцервикса выполняют эксцизии зоны трансформации и дистальной части цервикального канала. Это достигается путем двух последовательных LEEP- процедур («top hat»). При первой процедуре удаляют экзоцервикс, при второй небольшой конизации — дистальную часть цервикального канала (25.12). Эндоцервикальная поражения можно удалить и с помощью скальпеля и С02-лазера. Первой частью операции является широкая петлевая эксцизия (конизация) зоны трансформации, как описано выше. Вторая эксцизия выполняется после удаления первого образца и достижения гемостаза. При использовании тока 30-40 Вт маленькой петлей (4-5 мм) удаляют дистальную часть эндоцервикального канала. Следует стараться сохранить цервикальной строму при удалении дистальной части цервикального канала. Проводят гистологическое исследование препарата.
Комбинированная конизация. У молодых пациенток с экстенсивной интраэпителиальной неоплазией, что распространяется на цервикальный канал, выполняют комбинированную конизацию (25.13, 25.14). С целью удаления пораженного участка, но сохранение стромы и достаточного объема шейки матки осуществляют узкую эксцизии зоны эндоцервикального канала на 3 мм по его краями и глубиной 1-1,5 см. Затем проводят вапоризацию поражения эктоцервикса. Рану орошают физиологическим раствором. Пациентка нуждается в наблюдении в течение 6 недель. Ранними осложнениями конизации шейки матки могут быть кровотечение, инфекция, поздними — цервикальный стеноз или истмико-цервикальная недостаточность.
Цервикальный стеноз — рубцовое сужение цервикального канала от 2 до 0,5 мм. Стеноз цервикального канала может быть осложнением конизации шейки матки (скальпелем, лазером, электрохирургической), криохирургии, ампутации шейки матки, акушерской травмы, кюретажу цервикального канала и матки. Диагноз подтверждается кольпоскопией и зондированием канала. Лечение цервикального стеноза заключается в систематической последовательной дилатации расширителями, начиная с детских номеров. Дилатацию проводят еженедельно в амбулаторных условиях в течение 4 нед, с последующим ежемесячным контролем в течение 6 мес.
При тяжелом стенозе выполняют вапоризацию фибротизованои ткани до достижения слизистой оболочки и Экстериоризация жизнеспособного железистого эпителия с помощью С02-лазера с диаметром лазерного луча 1 мм. Цервикальный канал открывают разрезами «на 1-ю и 7 часов» от центра к периферии. Лазерный луч расширяют до 2 мм, мощность уменьшают до 5-10 Вт и проводят луч под эндоцервикальная слизистой оболочкой для ее еверсии. В канал вводят ватный аппликатор. После операции назначают 5 мл конъюгированных эстрогенов местно в течение 30 дней.
Цервикальные полипы — доброкачественное разрастание желез и стромы цервикального канала — могут визуализироваться при осмотре шейки матки в зеркалах и кольпоскопии. Маленький полип удаляют путем откручивания при захвате зажимом его ножки. Большие и многочисленные полипы подлежат Гистероскопическая исследованию с прицельным удалением и коагуляцией ножки полипа.


